
【题目】物质的组成与结构决定了物质的性质与变化,回答下列问题:
(1)量子力学把电子在原子核外的一个空间运动状态称为一个____________,电子除空间运动状态外,还有一种运动状态叫做____________。
(2)硒常用作光敏材料,基态硒原子的价电子排布式为_______________;与硒同周期的p区元素中第一电离能大于硒的元素有_________种。
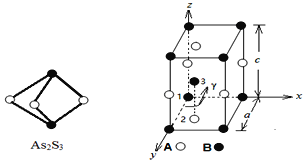
(3)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如下图,As原子的杂化方式为___________,雌黄和SnCl2在盐酸中反应转化为雄黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________________________。SnCl4分子的空间构型为_________________
(4)某晶体的晶胞结构如上图所示,该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o;1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),则3号原子坐标为_____________,计算上述晶体中A和B两原子间的最小核间距为_____________。(保留四位有效数字)
(5)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
【答案】 原子轨道 自旋 4s24p4 3 sp3杂化 2As2S3+2 SnCl2+4HCl = As4S4 + 2 SnCl4+2H2S↑ 正四面体形 AB (1/3,2/3,1/2) 144.6 pm 0.732r或(![]() -1)r
-1)r
【解析】(1)量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,电子除空间运动状态外,还有一种运动状态叫做自旋;正确答案:原子轨道; 自旋。
(2)Se原子序数为34,电子排布式:1s22s22p63s23p63d104s24p4,基态硒原子的价电子排布式:4s24p4; 第四周期元素中第一电离能大于硒的元素有溴、砷和氪,共3 种;正确答案:. 4s24p4 ;3。
(3)雌黄分子式为As2S3,根据分子结构图可分析,As原子的杂化方式为:sp3杂化;根据反应物和生成物:As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体,可以得出化学方程式为:2As2S3+2SnCl2+4HCl=As4S4+2SnCl4+2H2S↑;SnCl4分子sp3杂化 ,空间构型为正四面体;正确答案:sp3杂化;2As2S3+2 SnCl2+4HCl = As4S4 + 2 SnCl4+2H2S↑; 正四面体形 。
(4)根据晶胞结构图,顶点粒子占1/8,棱上粒子占1/4,面心粒子占1/2,晶胞内部粒子为整个晶胞所有,则一个晶胞中含有A的数目为4×1/4+2×1/2=2,含有B的数目为8×1/8+1=2,则A与B的数目为1:1,所以该晶体的化学式为AB;该晶胞参数为![]() ,
,![]() ,
,![]() ,已知原子坐标1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0), 3号原子在2号原子之上,且在整个晶胞的中间,则3号原子其实是放在2号原子的原子坐标为(1/3,2/3,1/2);根据晶胞结构,左下角顶点A粒子与底心上面的B粒子间的距离最短,根据原子坐标,可以发现底面的A原子起始位处正三角形重心,根据立体几何知识,根据余弦定理,
,已知原子坐标1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0), 3号原子在2号原子之上,且在整个晶胞的中间,则3号原子其实是放在2号原子的原子坐标为(1/3,2/3,1/2);根据晶胞结构,左下角顶点A粒子与底心上面的B粒子间的距离最短,根据原子坐标,可以发现底面的A原子起始位处正三角形重心,根据立体几何知识,根据余弦定理,![]() ,可得
,可得![]() ,这是底面最长对角线的距离,A和B的距离为其1/3,即
,这是底面最长对角线的距离,A和B的距离为其1/3,即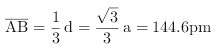 ;正确答案:AB ;(1/3,2/3,1/2); 144.6 pm 。
;正确答案:AB ;(1/3,2/3,1/2); 144.6 pm 。
(5)根据题意可知,立方体的棱长为2r,,则该立方体的面对角线为2√2r,该立方体的体对角线为:L2=(2√2r)2+(2r)2, L=2√3 r;立方体的中心能容得下半径最大的原子直径为2√3 r-2r,半径为(2√3 r-2r)/2=(![]() -1)r;正确答案0.732r或(
-1)r;正确答案0.732r或(![]() -1)r。
-1)r。


科目:高中化学 来源: 题型:
【题目】下列反应中,不属于可逆反应的是( )
A.Cl2与水反应
B.水电解生成H2 和H2在O2中燃烧生成水的相互转化过程
C.工业合成氨
D.氨气与水反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铷元素(Rb)位于元素周期表中第五周期第ⅠA族,有关Rb及其化合物的性质推测正确的是( )
A.Rb与冷水反应比K更剧烈
B.Rb投入CuSO4溶液中可置换出Cu
C.Rb与O2反应只有Rb2O产生
D.Rb2CO3难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水;草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象是________________________,由此可知草酸晶体分解的产物中有_______。
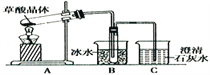
装置B的主要作用是_________________________________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和下图所示的部分装置进行实验。

①乙组的实验装置中,依次连接的合理顺序为A→B→(_____)→( )→( )→( )→I。装置H反应管中盛有的物质是__________;I中集气瓶收集到的气体主要是_________。
②能证明草酸晶体分解产物中有CO的现象是_______________________________。
(3)丙组同学欲进一步证明产物CO能否与Na2O2反应。从A~J中选用装置进行实验,最简单的装置接口连接顺序是:A→B→(_____)→J(盛Na2O2的干燥管);实验后用J中的固体进行验证的方法是:__________________________________(可另选试剂)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列各题:
Ⅰ.下列实验不能成功的是______________
A.为了检验R-X是碘代烷,将R-X与NaOH水溶液共热,经充分反应后冷却,向冷却液中加稀HNO3酸化后,再加AgNO3溶液,观察沉淀颜色
B.为检验淀粉是否水解,将淀粉与少量稀H2SO4共热一段时间,加入新制的Cu(OH)2 ,观察变化
C. 向银氨溶液中加入几滴乙醛后用酒精灯加热至沸制取银镜
D.无水乙醇与浓硫酸按1:3的体积比混合快速加热到170℃左右制取乙烯
Ⅱ.有机物M的结构简式为: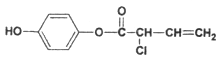 ,则:
,则:
(1)1 mol M最多消耗的H2、Br2、NaOH溶液的比值为_________________;
写出M在酸性(稀硫酸)条件下的水解反应方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应在生产生活中有很多实际应用:
Ⅰ.二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知:①Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;②2SO2+SeO2+2H2O=Se+2SO![]() +4H+。
+4H+。
(1)Se与浓H2SO4的反应中,氧化剂是_______还原剂是________。
(2)依据反应①判断SeO2、浓H2SO4的氧化性强弱是:SeO2 ______ 浓H2SO4(填大于、小于或等于).
(3)用双线桥法标出反应②电子转移的方向和数目:_________________。
(4)SeO2、KI和HNO3发生如下反应,配平该反应的化学方程式____________。
SeO2+KI+HNO3→Se+I2+KNO3+H2O
Ⅱ.对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(5)含氰废水中的CN-有剧毒。在微生物的作用下,CN-能够被氧气氧化成HCO![]() ,同时生成NH3,该反应的离子方程式为_____________________________________________。
,同时生成NH3,该反应的离子方程式为_____________________________________________。
(6)硫酸铜溶液能与单质磷反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4反应中,被1mol CuSO4 氧化的P的物质的量__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式错误的是( )
A. CaCl2=Ca2+ + 2Cl— B. CH3COOH =CH3COO—+ H+
C. KOH = K+ + OH— D. H2SO4= 2H+ + SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,利用生成的Fe2+可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如图。下列说法正确的是
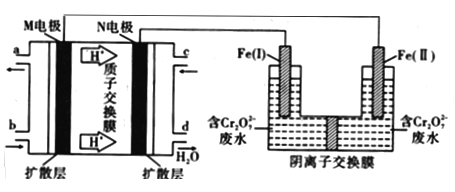
A. 由b口加入物质为O2
B. 燃料电池负极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C. 电解过程中,Fe(I)质量减少,Fe(Ⅱ)上有气体产生
D. 电路中每转移6mol电子,最多有1mol Cr2O72-被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com