
分析 根据方程式MCO3$\frac{\underline{\;高温\;}}{\;}$MO+CO2↑来计算;根据所求结果结合题意:金属M的氢氧化物的水合晶体M(OH)2•xH2O与Na2CO3的混合物共45.8g来计算.
解答 解:设M的相对原子质量为m,则:MCO3$\frac{\underline{\;高温\;}}{\;}$MO+CO2↑
m+60 m+16
9.85 7.65
$\frac{m+60}{9.85}$=$\frac{m+16}{7.65}$,解得:m=137,
M是Ba,m(MCO3)=(137+60)×b=9.850,即b=0.05 mol,m(M(OH)2•xH2O)+m(Na2CO3)=45.8,
即(137+34+18x)×0.1+106×0.05=45.8,解得x=13,所以M氢氧化物的水合晶体的化学式为Ba(OH)2•13H2O,
答:M的原子量137,M的氢氧化物的水合晶体的化学式为Ba(OH)2•13H2O.
点评 本题考查学生根据化学方程式来确定物质以及量的多少的计算能力,注意平时知识的积累,难度不大.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
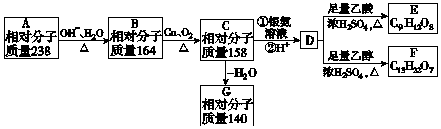
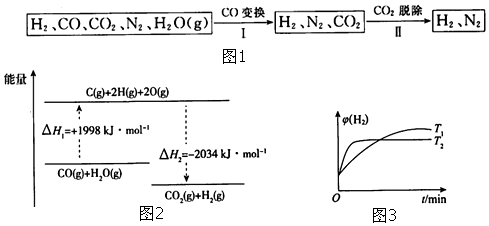
 .
.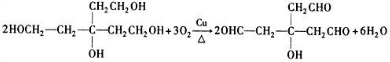 .
.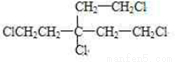 .
.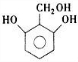 、
、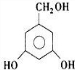 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
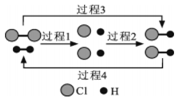 H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列属于吸热过程的是 ( )
H2 能在Cl2中燃烧生成 HCl,HCl也能在一定条件下分解为H2和Cl2. 图为H2、Cl2和HCl 三者相互转化的微观过程示意图,下列属于吸热过程的是 ( )| A. | 过程 1 | B. | 过程 2 | C. | 过程 3 | D. | 过程 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
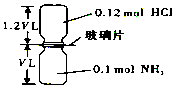 如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )
如图,抽去如图所示装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.(已知反应:HCl+NH3═NH4Cl(固体))下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42g | |
| C. | 生成物的分子数目为0.1NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
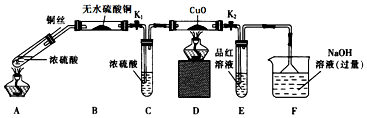
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
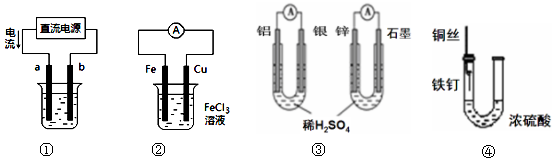
| A. | 用装置①精炼铜,则a极为粗铜,b为精铜,电解质溶液为CuSO4溶液 | |
| B. | 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ | |
| C. | 图③两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同 | |
| D. | 装置④中的铁钉几乎没被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成 0.1 NA 根共价键 | B. | 消耗反应物总体积 2.24L | ||
| C. | 转移了 2 NA 个电子 | D. | 产物溶于水后,溶液 pH=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
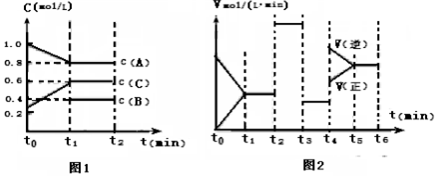
| 时间段 | t1~t2 | t2~t3 | t3~t4 | t5~t6 |
| 平衡常数 | K1 | K2 | K3 | K4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com