
分析 气态烃在标准状况下的密度为2.5g/L,则相对分子质量为2.5×22.4=56,计算1.12g烃的物质的量生成物通入足量的石灰水,产生8g白色沉淀,生成碳酸钙,可知n(CO2),进而确定有机物含有C、H个数,可确定分子式将该烃通入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,说明含有C=C键以此确定结构简式.
解答 解:气态烃在标准状况下的密度为2.5g/L,则相对分子质量为2.5×22.4=56,1.12g烃的物质的量为$\frac{1.12g}{56g/mol}$=0.02mol,生成物通入足量的石灰水,产生8g白色沉淀,生成碳酸钙,可知n(CO2)=$\frac{8g}{100g/mol}$=0.008mol,则1mol有机物含有4molC,则含有的H原子个数为$\frac{56-4×12}{1}$=8,分子式为C4H8,将该烃通入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,说明含有C=C键,可能的结构简式为CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2,
答:该烃的分子式为C4H8;该烃可能的结构简式为CH2=CHCH2CH3、CH3CH=CHCH3、CH2=C(CH3)2.
点评 本题考查了有机物推断、同分异构体书写等知识,为高频考点,侧重考查学生的分析能力和计算能力,比较基础,注意掌握有机物同分异构体.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{q(am+bn)}{c(m+n-p)}$ | B. | $\frac{c(m+n-p)}{1000q(am+bn)}$ | ||
| C. | $\frac{c(m+n-p)}{q(am+bn)}$ | D. | $\frac{1000q(am+bn)}{c(m+n-p)}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5molCl2通入足量水中充分反应.转移的电子数等于0.5NA | |
| B. | 46gNO2和N2O4混合气体中含有原子总数为3NA | |
| C. | 标准状况下,22.4LSO3中含有的分子数为NA. | |
| D. | 1L0.1mol/L的NaHSO3溶液中,HSO32-、SO32-的离子数之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25.2g | B. | 18.9g | C. | 23.4g | D. | 48.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
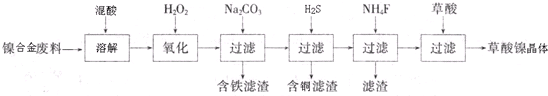
| A. | 1.0mol的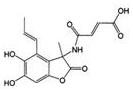 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol 与NaOH溶液和H 2反应时,分别需要消耗NaOH 6.0mol和H 25.0mol | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na 2CO 3溶液鉴别 | |
| C. | 桶烯(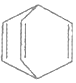 )与苯乙烯 )与苯乙烯 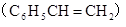 互为同分异构体,均属于芳香烃 互为同分异构体,均属于芳香烃 | |
| D. | 按系统命名法,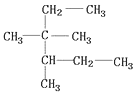 的名称为3,3二甲基2乙基戊烷 的名称为3,3二甲基2乙基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO- | B. | SO32- | C. | CO32- | D. | HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com