
【题目】科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
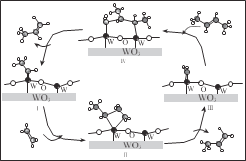
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
【题目】某小组利用下面的装置进行实验,②、③中溶液均足量,操作和现象如下表
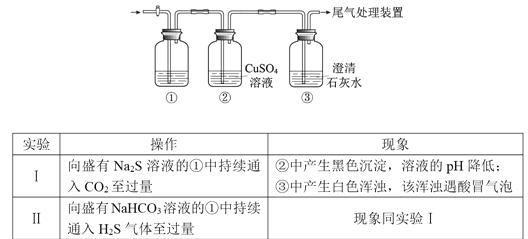
资料:CaS遇水完全水解
由上述实验得出的结论不正确的是
A.③中白色浑浊是CaCO3
B.②中溶液pH降低的原因是:H2S+Cu2+=CuS↓+2H+
C.实验①中CO2过量发生的反应是:CO2+H2O+S2-=CO32-+H2S
D.由实验I和II不能比较H2CO3和H2S酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧燃料电池是的介色化学理的新型发电装置,下图为电池示意图,该电池电极表面镀一层细细的铂粉,吸附气体的能力强,性质稳定,请回答
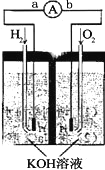
(1)氢氧燃料电量的转化形式是____,在导线中电了的流动方向为______(用a,b表示)
(2)负极反应式为___________
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能,因此大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I .2Li+H2=2LiH; II. LiH+H2O=LiOH+H2↑
①反应I中的还原剂是______,反应II中的氧化剂是______
②由LiH与H2O作用,放出224L(标准状况)H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为____mol;将产生的电能用来电解饱和食盐水,产生的氢气体积(标准状况)为_____L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼(BCl3)是一种重要的化工原料。实验室制备BCl3的原理B2O3+3C+3Cl2 =2BCl3+3CO,某实验小组利用干燥的氯气和下列装置(装置可重复使用)制备BCl3并验证反应中有CO生成。已知:BCl3的熔点为-107.3℃,沸点为12.5℃,遇水水解生成H3BO3和HCl,请回答下列问题:
(实验Ⅰ)制备BCl3并验证产物CO
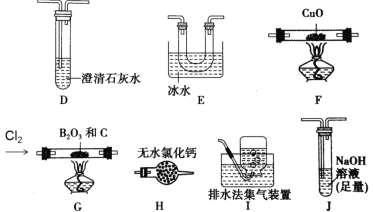
(1)该实验装置中合理的连接顺序为G→_____→_____→_____→____→F→D→I。其中装置E的作用是___________________________。
(2)装置J中反应的化学方程式为____________________________________。
(实验Ⅱ)产品中氯含量的测定
①准确称取少许m克产品,置于蒸馏水中完全水解,并配成100mL溶液。
②取10.00mL溶液于锥形瓶中
③加入V1mL浓度为C1 mol/LAgNO3溶液使氯离子完全沉淀;向其中加入少许硝基苯用力摇动。
④以硝酸铁为指示剂,用C2 mol/L KSCN标准溶液滴定过量的AgNO3溶液。发生反应:Ag+ +SCN- =AgSCN↓。
⑤重复步骤②~④二次,达到滴定终点时用去KSCN溶液的平均体积为V2 mL。
已知: Ksp(AgCl)>Ksp(AgSCN) 。
(3)步骤④中达到滴定终点的现象为__________________。
(4)实验过程中加入硝基苯的目的是___________________。
(5)产品中氯元素的质量分数为_________________%。
(6)下列操作,可能引起测得产品中氯含量偏高是__________。
A.步骤③中未加硝基苯
B.步骤①中配制100mL溶液时,定容时俯视刻度线
C.用KSCN溶液滴定剩余AgNO3溶液时,滴定前有气泡,滴定后无气泡
D.滴定剩余AgNO3溶液时,KSCN溶液滴到锥形瓶外面一滴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是
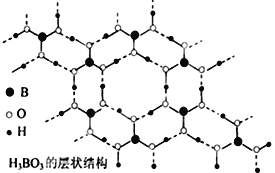
A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加 0.1 mol·L 1NaOH 溶液, 其 pH 变化分别对应下图中的Ⅰ、Ⅱ。下列说法不正确的是

A.向 NaA 溶液中滴加 HB 可产生 HA
B.a点,溶液中微粒浓度:c(A-) > c(Na+) > c(HA)
C.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)= c(B-)
D.滴加 20 mL NaOH 溶液时,Ⅰ中 H2O 的电离程度大于Ⅱ中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某草药中有一种色素,它的结没食子儿茶素的结构简式如图,它是目前尚不能人工合成的纯天然、高效能的抗氧化剂.下列关于该物质的叙述正确的是( )
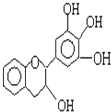
A.分子式为C15H12O5
B.1 mol 该物质与4mol NaOH恰好完全反应
C.该物质在浓硫酸作用下可发生消去反应
D.该物质可以和溴水发生取代反应和加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇不仅是重要的化工原料,而且还是性能优良的能源和车用燃料。
Ⅰ.甲醇水蒸气重整制氢是电动汽车氢氧燃料电池理想的氢源,生产过程中同时也产生CO,CO会损坏燃料电池的交换膜。相关反应如下:
反应①CH3OH(g) + H2O(g)CO2(g) + 3H2(g) △H1
反应②H2(g)+CO2(g)CO(g) + H2O(g) △H2=+41kJ/mol
如图表示恒压容器中0.5mol CH3OH(g)和0.5mol H2O(g)转化率达80%时的能量变化。
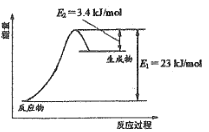
(1)计算反应①的△H1= ________。
(2)反应①能够自发进行的原因是________。升温有利于提高CH3OH转化率,但也存在一个明显的缺点是 _________。
(3)恒温恒容下,向密闭容器中通入体积比为1:1的H2和CO2,能判断反应CH3OH(g) + H2O(g)CO2(g) + 3H2(g)处于平衡状态的是____________。
A.体系内压强保持不变
B.体系内气体密度保持不变
C.CO2的体积分数保持不变
D.断裂3mol H-H键的同时断裂3mol H-O键
(4)250℃,一定压强和催化剂条件下,1.00mol CH3OH 和 1.32mol H2O充分反应,平衡测得H2为2.70mol,CO为 0.030mol,则反应①中CH3OH的转化率_________,反应②的平衡常数是 _________(以上结果均保留两位有效数字)。
Ⅱ.如图是甲醇燃料电池工作示意图:
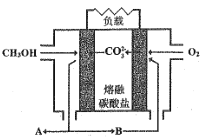
(5)当内电路转移1.5molCO32-时,消耗甲醇的质量是_________g。
(6)正极的电极反应式为 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T℃下,向装有5mL0.005mol.L-1FeCl3溶液的试管中加入5mL0.01mol·L-1KSCN溶液,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
Fe(SCN)3+3KCl,溶液呈血红色。下列叙述正确的是( )
A.升高温度,逆反应速率减小
B.加入Fe2(SO4)3固体,溶液血红色加深
C.加入KCl固体,溶液血红色加深
D.增大压强,溶液血红色加深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com