
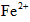 34%~36%,是糖衣片,……,与
34%~36%,是糖衣片,……,与 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验: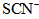 生成
生成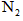 、
、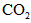 和SO42-,也可以将
和SO42-,也可以将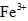 氧化成
氧化成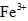 。
。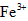 离子存在。该离子存在的原因可能是(填序号):___________________
离子存在。该离子存在的原因可能是(填序号):___________________ 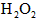 溶液,溶液的红色先变深,之后红色逐渐褪去。
溶液,溶液的红色先变深,之后红色逐渐褪去。  片,片刻后溶液红色也褪去,说明
片,片刻后溶液红色也褪去,说明 有___________性。
有___________性。
科目:高中化学 来源:2013-2014学年上海市六校高三第二次联考化学试卷(解析版) 题型:填空题
2013年底,上海青浦发生一家三口误食亚硝酸盐造成两男孩身亡的惨剧。常见的亚硝酸盐主要是亚硝酸钠(NaNO2),它是一种白色不透明晶体,虽然形状很像食盐,而且有咸味,但有毒。亚硝酸钠和氯化钠的部分资料如下表:
|
|
亚硝酸钠(NaNO2) |
氯化钠(NaCl) |
|
水溶性 |
易溶,溶液呈弱碱性 |
易溶,溶液呈中性 |
|
熔点 |
271℃ |
801℃ |
|
沸点 |
320℃会分解 |
1413℃ |
|
跟稀盐酸作用 |
有红棕色的NO2气体放出 |
无反应 |
完成下列填空:
(1)氮元素最外层电子排布式为________,氮原子核外电子共占据了___个轨道。亚硝酸钠中各元素原子半径由大到小依次为_________,亚硝酸的电离方程式为:_______________________。
(2)亚硝酸盐中毒是因为亚硝酸盐可将正常的血红蛋白氧化成高铁血红蛋白,即血红蛋白中的铁元素由二价变为三价,失去携氧能力,使组织出现缺氧现象.美蓝是亚硝酸盐中毒后的有效解毒剂.下列说法不正确的是( )
A.高铁血红蛋白的还原性比亚硝酸盐弱
B.药品美蓝应具有还原性
C.中毒时亚硝酸盐发生还原反应
D.解毒时高铁血红蛋白被还原
(3)NaNO2有毒,将含该物质的废水直接排放会引起水体的严重污染,所以这种废水必须处理后才能排放。处理方法之一:在酸性条件下, NaNO2与KI的物质的量为1:1时恰好完全反应,且I-被氧化为I2,此时产物中含氮的物质(A)为________(填化学式)。若利用上述方法制A,现有两种操作步骤:①先将废水酸化后再加KI;②先将KI酸化后再加入废水。哪种方法较好?____(填序号。假设废水中其它物质不反应)
(4)如要鉴别亚硝酸钠和氯化钠固体,下列方法不可行的是
A.观察并比较它们在水中的溶解速度 B.测定它们各自的熔点
C.在它们的水溶液中滴加甲基橙 D.在酸性条件下加入KI淀粉试液
查看答案和解析>>
科目:高中化学 来源:专项题 题型:填空题
 O2+HbCO,导致人体缺氧。某实验室模拟研究上述过程。
O2+HbCO,导致人体缺氧。某实验室模拟研究上述过程。
(1)0~3 s间用HbO2表示的平均反应速率为___________;第9 s时HbCO的浓度为 __________,根据曲线Ⅱ计算反应CO+HbO2 O2+HbCO的平衡常数的值为____________。
O2+HbCO的平衡常数的值为____________。
(2) HbCO的浓度超过HbO2浓度的1倍,就会有重度一氧化碳中毒的症状。下列有关一氧化碳中毒的说法错误的是________。
A.人体吸入的CO越多,与血红蛋白结合的O2越少
B.空气中CO和O2的比为1:10时,不会发生重度一氧化碳中毒
C.发现轻度一氧化碳中毒时,及时开窗通风有利于缓解中毒情况
D.使用煤炉在室内取暖可能会产生一氧化碳中毒
(3)将病人放入高压氧舱是治疗一氧化碳中毒的常用方法,试用化学反应原理简述其治疗原理_________。
(4)血红蛋白的携氧功能和其含有的二价铁(用Fe2+表示)关系密切,若误将亚硝酸钠摄人体内也会导致组织缺氧而中毒,写出在酸性条件下其反应的离子方程式______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com