
| A. | N2、O2和Cl2分子中既含有σ键,又含有π键 | |
| B. | PCl3分子中,中心原子采取SP3杂化方式 | |
| C. | CS2、H2O、C2H2都是直线型分子 | |
| D. | CH4、CCl4、C6H6都是只含有极性键的非极性分子 |
分析 A.单键均为σ键,双键、三键中均含σ键、π键;
B.根据中心原子的价层电子对数判断,价层电子对个数=σ键个数+孤电子对个数;
C.H2O是V形分子;
D.不同非金属原子间形成极性键,相同非金属原子间形成非极性键.
解答 解:A.N2中含有三键,O2中含有双键,所以N2、O2分子中既含有σ键,又含有π键,Cl2分子只有单键,即只含有σ键,故A错误;
B.PCl3分子中P的价层电子对个数=3+$\frac{1}{2}$(5-3×1)=4,则中心原子采取SP3杂化方式,故B正确;
C.H2O是V形分子,CS2、C2H2都是直线型分子,故C错误;
D.CH4、CCl4只含有极性键,结构对称属于非极性分子,C6H6中含有非极性键和极性键,是非极性分子,故D错误.
故选B.
点评 本题考查了共价键、分子的极性、原子杂化方式的判断,根据价层电子对互斥理论来分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:推断题
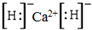 ;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
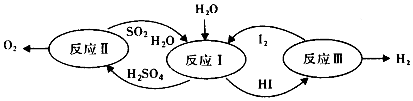
| A. | 设计该循环是为了制取能源气体O2 | |
| B. | 整个循环过程中产生1mol O2的同时产生1molH2 | |
| C. | 图中反应Ⅰ、Ⅱ、Ⅲ均可在常温常压下进行 | |
| D. | 图中反应Ⅰ、Ⅱ、Ⅲ均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
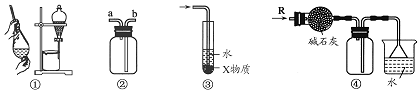
| A. | 装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| B. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置①可用于分离C2H5OH和H2O的混合物 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═H++SO42- | D. | Al2(SO4)3═2Al3++3SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
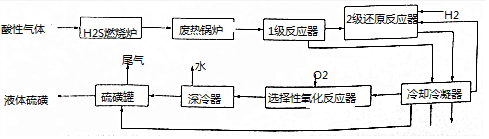
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 明矾能水解生成Al(OH)3胶体,可用作水的消毒剂 | |
| C. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com