
| A. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2 与 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O互为可逆反应 | |
| B. | 可逆反应在一定条件下可达到平衡状态,该状态下,正、逆反应速率相等,都为零 | |
| C. | 可逆反应不能进行到底,必然有反应物剩余 | |
| D. | 可逆反应的速率很小,达到最大限度时反应停止 |
分析 A.可逆反应的反应条件相同;
B.化学平衡为动态平衡;
C.可逆反应不能完全转化;
D.反应速率与转化的限度无关.
解答 解:A.可逆反应的反应条件相同,则2H2O$\frac{\underline{\;电解\;}}{\;}$2H2+O2 与 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O中条件不同,不是可逆反应,故A错误;
B.化学平衡为动态平衡,则达到平衡状态,该状态下,正、逆反应速率相等,且都不为零,故B错误;
C.可逆反应不能完全转化,则可逆反应不能进行到底,必然有反应物剩余,故C正确;
D.反应速率与转化的限度无关,反应速率很小,不能判断反应限度,且达到限度时反应不会停止,故D错误;
故选C.
点评 本题考查可逆反应及化学平衡,为高频考点,把握可逆反应的判断、平衡的特征为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
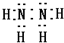 .②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
.②N2H4•2H2O在水中第一步电离的电离方程式为N2H4•2H2O?[N2H5•H2O]++OH-.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
,遇水剧烈反应产生大量气体,其反应化学方程式为NaAlH4+2H2O=NaAlO2+4H2↑.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
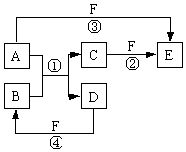 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件和部分副产 物未标出),其中反应①是置换反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 15g甲基(CH3-)中含有电子的数目为10mol | |
| B. | 煤的干馏和石油的分馏都是化学变化 | |
| C. | 可用溴水鉴别四氯化碳和己烷两种无色液体 | |
| D. | 苯既不能使溴水褪色也不能使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时粗铜做阳极,发生的电极反应为Cu2++2e-=Cu | |
| B. | 一定条件下,使用催化剂能同时提高反应速率和反应物的平衡转化率 | |
| C. | NH4HSO4溶液呈酸性,主要原因是NH4+的水解促进了水的电离 | |
| D. | 常温下加水稀释CH3COOH 溶液,稀释过程中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)c(O{H}^{-})}$不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com