
| A. | 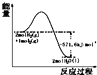 表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ/mol | |
| B. |  由图得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右 | |
| C. |  表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a | |
| D. |  表示常温下向体积为10 mL 0.1 mol/LNaOH溶液中逐滴加入0.1 mol/L CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) 表示常温下向体积为10 mL 0.1 mol/LNaOH溶液中逐滴加入0.1 mol/L CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) |
分析 A、氢气在氧气中燃烧的反应是放热的,燃烧热是完全燃烧1mol物质生成稳定产物所放出的热量;
B、除去CuSO4溶液中的Fe3+,可以根据铁离子水解平衡的移动知识来判断;
C、用水稀释pH相同的盐酸和醋酸,盐酸的pH变化较大,醋酸的pH变化小,溶液的导电能力取决于自由移动离子的浓度的大小;
D、体积为10 mL 0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1 CH3COOH溶液后,所得的溶液是醋酸钠溶液,根据质子守恒来回答.
解答 解:A、氢气在氧气中燃烧的反应是放热的,燃烧热是完全燃烧1mol氢气生成稳定产物液态水所放出的热量,即H2的燃烧热为285.8 kJ•mol-1,故A正确;
B、除去CuSO4溶液中的Fe3+,向溶液中加入适量CuO,调节溶液的pH至4左右,铁离子水解完全转化为氢氧化铁铁沉淀,可以除去CuSO4溶液中的Fe3+,故B正确;
C、用水稀释pH相同的盐酸和醋酸,盐酸的pH变化较大,醋酸的pH变化小,溶液的导电能力取决于自由移动离子的浓度的大小,即其中Ⅰ表示盐酸,Ⅱ表示醋酸,且溶液导电性:c>b>a;故C错误;
D、体积为10 mL 0.1 mol•L-1NaOH溶液中逐滴加入0.1 mol•L-1 CH3COOH溶液后,所得的溶液是醋酸钠溶液,存在质子守恒c(CH3COOH)+c(H+)=c(OH-),故D正确;
故选C.
点评 本题综合考查学生弱电解质的电离平衡、酸的稀释以及燃烧热的判断等方面的知识,属于综合知识的考查,难度中等.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
 已知反应X(g)+Y(g)═nZ(g)△H>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示.下列说法不正确的是( )
已知反应X(g)+Y(g)═nZ(g)△H>0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示.下列说法不正确的是( )| A. | 反应方程式中n=1 | |
| B. | 10min时,曲线发生变化的原因是升高温度 | |
| C. | 10min时,曲线发生变化的原因是增大压强 | |
| D. | 该反应的△S<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+Cl2→CH2ClCH2Cl 加成反应 | |
| B. | 2CH3CHO+O2→2CH3COOH 加成反应 | |
| C. | CH3COOCH2CH3+H2O→CH3COOH+CH3CH2OH 取代反应 | |
| D. | C6H6+H2SO4→C6H5-SO3H+H2O 取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持体积不变,向平衡体系中加入B,平衡可能向逆反应方向移动 | |
| B. | 平衡时,单位时间内c(A)消耗:c(C)消耗=1:1 | |
| C. | 产物B的状态只能为固态或液态 | |
| D. | 若开始时向容器中加入1mol B和1mol C,达到平衡时放出热量QkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2催化氧化反应中,为提高SO2的转化率,使用过量O2 | |
| B. | 在FeSO4溶液中,加入铁粉以防止氧化 | |
| C. | 黄绿色的氯水光照后颜色变浅 | |
| D. | 在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com