
【题目】下列物质的用途错误的是( )
A.明矾:净水剂B.过氧化钠:供氧剂和漂白剂
C.碳酸氢钠:胃酸中和剂D.生石灰:食品抗氧化剂
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是
2SO3(g) ΔH<0。在其他条件一定,只改变某一条件时,下列分析不正确的是

A. 图Ⅰ表示的是t1时刻增大压强对反应速率的影响
B. 图Ⅱ表示的是t1时刻加入催化剂对反应速率的影响
C. 图Ⅲ表示的是温度对平衡的影响,且甲的温度小于乙的温度
D. 图Ⅲ表示的是催化剂对化学平衡的影响,乙使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.如图所示为常见玻璃仪器的部分结构:
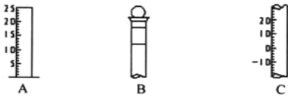
(1)请写出所列仪器的名称:A__________,B____________;C_____________;
(2)仪器 B 使用前必须______________________。
(3)仪器 B 上标记有__________________(填序号);
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
II. 某无色工业废水中可能含有Na+、Mg2+、Al3+、Cl-、SO42-中的几种离子。
a.取少许该废水于试管中,加入足量的Ba(NO3)2溶液和稀硝酸,产生白色沉淀,充分反应后过滤,向滤液中加入AgNO3溶液无沉淀产生。
b.另取10mL该废水于试管中,滴加NaOH溶液先产生白色沉淀,后部分沉淀溶解。生成沉淀的物质的量随加入NaOH的物质的量关系如下图所示。
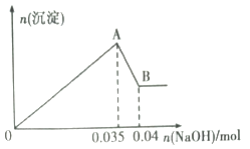
根据上述实验和图中数据:
(1)该废水中一定不含有的离子有________________(填离子符号);
(2)写出A→B过程中发生反应的离子方程式:_________________;
(3)该废水中,c(Al3+)=________________________;
(4)①实验室配制100mL2mol/L的NaOH溶液时,用到的玻璃仪器除烧杯、玻璃棒、量筒外,还需要________(填仪器名称)。
②下列操作使所配溶液浓度偏大的是(填写字母)________。
A.称量用了生锈的砝码
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体贱出
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有未知浓度的Ba(OH)2和NaOH混合溶液,量取四份该溶液分别通入等量的CO2(已折算成标准状况下的体积,不考虑CO2在水中的溶解),生成沉淀的物质的量如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
CO2体积(mL) | 2352 | 2352 | 2352 | 2352 |
样品体积(mL) | 20.0 | 30.0 | 40.0 | 50.0 |
沉淀物质的量(×10-2mol) | 1.50 | 4.50 | 6.00 | 7.50 |
(1)该混合溶液中Ba(OH)2的物质的量浓度=_____________。
(2)实验Ⅲ最后所得溶液中碳酸钠的物质的量=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.10 mol·L-1的NaOH溶液,整个过程中溶液pH变化的曲线如图所示。下列叙述中正确的是

A. 点①所示溶液中:c(H+)=c(Cl-)+c(HClO)+c(OH-)
B. 点②所示溶液中:c(H+)>c(Cl-)>c(ClO—)>c(HClO)
C. 点③所示溶液中:c(Na+)=2c(ClO-)+c(HClO)
D. 点④所示溶液中:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2和熔融NaNO3可制作燃料电池,其原理如图,下列判断正确的是
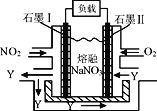
A. 石墨电极Ⅱ为电池负极
B. 电池中NO3-从石墨电极I向石墨电极Ⅱ作定向移动
C. 石墨I电极发生的电极反应为NO2+NO3--e-=N2O5
D. 每消耗1 mol NO2转移电子2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 56 g Fe 与1mol Cl2充分反应,转移的电子数为3NA
B. 分子数为 0.1NA的CH4和NH3混合气体,含有的共用电子对数为0.4NA
C. 25℃时,1L pH=12的Ba(OH)2溶液中含有0.02NA 的OH-
D. 常温常压下,22 g D3O+中含有10NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一恒温、恒容的密闭容器中发生反应:3H2(g)+N2(g)![]() 2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是
2NH3(g) ΔH<0。t1时刻反应达到平衡,在t2时刻改变某一条件,其反应过程如图所示。下列说法正确的是

A. Ⅰ、Ⅱ两过程达到平衡时,平衡常数:KⅠ<KⅡ
B. Ⅰ、Ⅱ两过程达到平衡时,NH3的体积分数:Ⅰ<Ⅱ
C. Ⅰ、Ⅱ两过程达到平衡的标志:气体的平均密度不再发生变化
D. t2时刻改变的条件可以是向密闭容器中加H2和N2的混合气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅石(主要成分SiO2)为起始原料生产高纯多晶硅的简化工艺流程如下图所示:
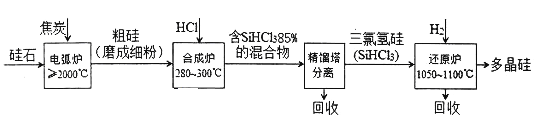
(1)在电弧炉中,生成粗硅的化学方程式为____________,该反应氧化剂与还原剂物质的量之比为_____________。
(2)合成炉中有关反应的数据如下表所示:
热化学方程式 | 平衡常数 | |
主反应 | Si(s)+3HCl(g) | K1 |
副反应 | Si(s)+4HCl(g) | K2 |
①主反应的温度需严格控制在280~300℃之间,若温度过低,则__________________;若温度太高,SiHCl3则会转化生成SiCl4,该转化的热化学方程式为_____________________。
②平衡时,![]() 的值a随着
的值a随着![]() 的值b的变化而变化,则
的值b的变化而变化,则![]() =______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高
=______(用含K1、K2的代数式表示)。工业上用H2适当稀释HCl来提高![]() 的值,请用平衡移动原理加以解释________________________。
的值,请用平衡移动原理加以解释________________________。
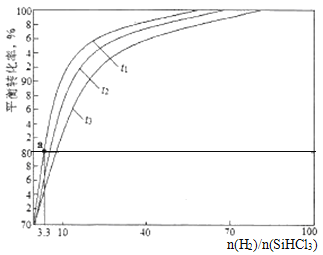
(3)还原炉中的主要反应为SiHCl3(g)+H2(g)=Si(s)+3HCl(g) △H>0。实验室中在1.0L密闭容器中研究得到SiHCl3的转化率在不同温度条件下随n(H2)/(SiHCl3)变化的曲线如图所示。t1、t2、t3表示的温度高低顺序为_______;t1温度时平衡常数Ka=______(保留两位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com