
 W是由A、B两种元素组成的AB2型化合物.
W是由A、B两种元素组成的AB2型化合物. .
.分析 (1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2;
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+,往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明W含有I-,往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+,故W为FeI2;
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2;
(4)①若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化生成H2SeO4;
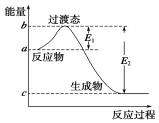
(5)0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g),原子守恒和氧化还原反应电子守恒可知W为NO2,能量变化可知为放热反应反应焓变△H=E1-E2,结合热化学方程式书写方法写出.
解答 解:(1)若W和焦炭在高温下发生反应,所制得的半导体材料应用广泛,则W为SiO2,该反应方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:SiO2 ;
(2)若取两支试管分别加入少量W溶液,往一支试管中滴入KSCN溶液,无明显现象,则W不含Fe3+,往另一支试管中加入足量氯水,再加入适量CCl4,振荡,静置,下层溶液呈紫红色,说明W含有I-,往上层溶液中滴入KSCN溶液,溶液呈红色,则W含有Fe2+,故W为FeI2.
①W溶液中所含金属阳离子为:Fe2+,故答案为:Fe2+;
②W(FeI2)与足量氯水反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-,
故答案为:2Fe2++4I-+3Cl2=2Fe3++I2+6Cl-;
(3)若W是离子化合物,其阴、阳离子均含18个电子,且阴、阳离子个数比为1:1,则W为CaO2.
①CaO2中阴离子的电子式为: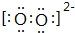 ,故答案为:
,故答案为: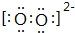 ;
;
②发生反应:2CaO2+2H2O=2Ca(OH)2+O2↑,反应中CaO2既是氧化剂又是还原剂,1mol CaO2与足量水充分反应生成0.5mol氧气,转移电子的物质的量为0.5mol×2=1mol,故答案为:1;
(4)若A、B是同主族元素,W溶于水生成一种二元弱酸,为VIA族元素,B为O元素;
①氧元素处于周期表中第二周期VIA族,故答案为:第二周期VIA族;
②如果A元素的周期序数是B元素的两倍,则A为Se,W为SeO2,SeO2的水溶液被双氧水氧化的化学方程式为:H2SeO3+H2O2=H2SeO4+H2O,
故答案为:H2SeO3+H2O2=H2SeO4+H2O;
(5)0.5molW (g)和0.5mol CO(g)反应生成CO2(g)和NO(g),碳元素化合价+2价升高到+4价,电子转移=0.5mol×2=1mol,则0.5molW (g)中氮元素化合价变化降低,变化过程中的电子转移=1mol=(4-2)×0.5mol=1mol,W为NO2,能量变化可知为放热反应反应焓变△H=E1-E2,1molNO2和 1molCO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=$\frac{{E}_{1}-{E}_{2}}{0.5}$KJ/mol/L=2(E1-E2)KJ/mol,
故答案为:NO2(g)+CO(g)=CO2(g)+NO(g)△H=2(E1-E2)KJ/mol.
点评 本题考查无机物推断、物质性质、电子式和热化学方程式书写,侧重考查特殊组成物质的性质,属于并列型题目,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:解答题
| 时间/s | c(NO)/mol•L-1 | c(CO)/mol•L-1 |
| 0 | 1.00×10-3 | 3.60×10-3 |
| 1 | 4.50×10-4 | 3.05×10-3 |
| 2 | 2.50×10-4 | 2.85×10-3 |
| 3 | 1.50×10-4 | 2.75×10-3 |
| 4 | 1.00×10-4 | 2.70×10-3 |
| 5 | 1.00×10-4 | 2.70×10-3 |
| 化学式 | 电离常数 |
| H2SO3 | K1=1.3×10-2,K2=6.2×10-8 |
| H2CO3 | K1=4.3×10-7,K2=5.6×1011 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定.| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 | 9.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 橙花醛不能与Br2发生加成反应 | |
| B. | 橙花醛能发生银镜反应 | |
| C. | 1 mol橙花醛最多可以与2 mol H2发生加成反应 | |
| D. | 橙花醛是乙烯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
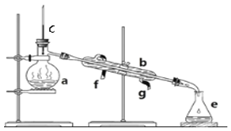 掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.
掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液 | B. | 0.5mol•L-1H2SO4 | ||
| C. | 0.5mol•L-1HCl | D. | 0.5mol•L-1CH3COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com