
| A. | 不用稀硫酸,改用98%浓硫酸 | B. | 改用热的稀硫酸溶液 | ||
| C. | 滴加少量CuSO4溶液 | D. | 不用铁片,改用铁粉 |
科目:高中化学 来源: 题型:解答题
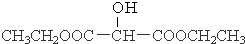 .
.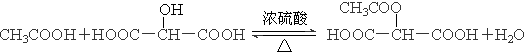 .
.
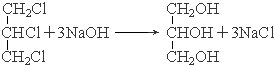 .
.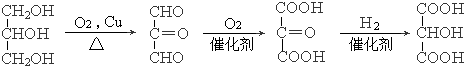 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
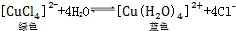 .下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )
.下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
.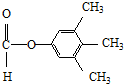 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
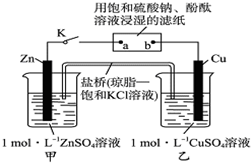
| A. | 电子沿Zn→a→b→Cu路径流动 | B. | Cu电极上发生氧化反应 | ||
| C. | 片刻后可观察到滤纸a点变红色 | D. | 片刻后甲池中c(SO42-)增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素编号 | a | b | c | d | e | f | g |
| 原子半径/nm | 0.037 | 0.074 | 0.082 | 0.102 | 0.143 | 0.152 | 0.186 |
| 最高化合价或最低化合价 | +1 | -2 | +3 | -2 +6 | +3 | +1 | +1 |
| A. | 氢化物稳定性的强弱:b>d | |
| B. | 元素e的氧化物只能与酸反应 | |
| C. | 金属性的强弱:f<g | |
| D. | 元素a与元素d形成的化合物属于共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com