
【题目】解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃、1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
(2)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。试根据表中所列键能数据计算a的数值____________。
(3)已知:C(s,石墨)+O2(g)===CO2(g)ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l)ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l)ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g) ΔH=________。
【答案】H2(g)+![]() O2(g)===H2O(l) ΔH=-286 kJ/mol)391+226.7 kJ·mol-1
O2(g)===H2O(l) ΔH=-286 kJ/mol)391+226.7 kJ·mol-1
【解析】
(1)燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;根据n=m/M计算1mol氢气完全燃烧放出的热量,结合热化学方程式的书写方法写出热化学方程式;
(2)根据反应热等于反应物的总键能-生成物的总键能求算;
(3)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
利用盖斯定律将①×2+②×![]() - ③×
- ③×![]() 计算反应热。
计算反应热。
(1)4g氢气即2mol在O2中完全燃烧生成液态水,放出572kJ的热量,则1mol氢气在氧气中燃烧生成液态水,放出286kJ的热量,则表示H2的燃烧热的热化学方程式为:H2(g)+1/2O2(g)═H2O(l)△H=-286kJ/mol,
故答案为:H2(g)+![]() O2(g)═H2O(l)△H=-286kJ/mol;
O2(g)═H2O(l)△H=-286kJ/mol;
(2)N2(g)+3H2(g)![]() 2NH3(g)△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,解得:a=391 kJmol-1,
2NH3(g)△H=945kJmol-1+436kJmol-1×3-akJmol-1×6=-93kJmol-1,解得:a=391 kJmol-1,
故答案为:391;
(3)①C(s,石墨)+O2(g)═CO2(g)△H=-393.5kJmol-1
②2H2(g)+O2(g)═2H2O(l)△H=-571.6kJmol-1
③2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-2599kJmol-1
利用盖斯定律将①×2+②×![]() - ③×
- ③×![]() 可得:
可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=(-393.5kJ/mol)×2+1/2×(-571.6kJ/mol)-1/2×(-2599 kJ/mol)=+226.7kJmol-1,
故答案为:+226.7kJmol-1。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 有机物只能从有机体中取得
B. 有机物和无机物的组成、结构、性质有严格区别,它们不能相互转化
C. 人类只是从现代才使用有机物
D. 合成树脂、合成橡胶、合成纤维等均属于有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是日常生活中不可缺少的调味品。已知C可在D中燃烧发出苍白色火焰。M与其他物质间的转化关系如下图所示(部分产物已略去)
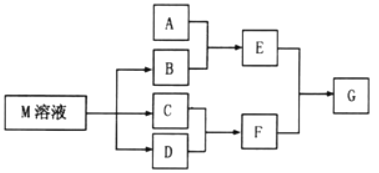
(1)若A是地売中含量最多的金属元素,将A的氯化物溶液和氢氧化钠溶液等体积混合,得到的沉淀物中A元素与溶液中A元素的质量相等,则A的该氯化物溶液和氢氧化钠溶液的物质的量浓度之比可能为________________________________。
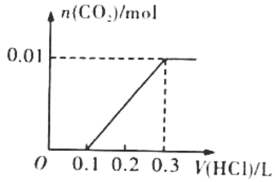
(2)若A是CO2气体,A与B溶液反应后所得的溶液再与盐酸反应,放出气体的物质的量与所加盐酸体积之间的关系如右图所示,则A与B溶液反应后溶液中的溶质为____________________(填化学式),物质的量之比为_______。
(3)若A是一种正盐,A能分别与B、F溶液反应生成无色且具有刺激性气味的气体,则A的化学式为_____________。
(4)若A是一种盐,A溶液与B溶液混合将产生白色絮状沉淀且瞬间变为灰绿色,最后变成红褐色的E,向G溶液中加入KSCN后溶液显红色,则由A转化成E的离子方程式是____________________________________________________。
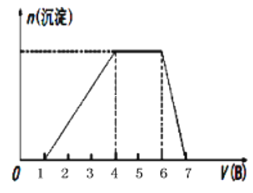
(5)若A是一种溶液,只可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-中的某些离子,当向该溶液中加入B溶液时发现生成沉淀的物质的量随B溶液的体积发生如右图所示变化,由此可知,该溶液中肯定含有的离子为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
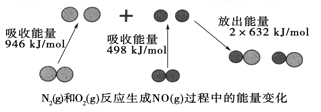
下列说法中正确的是
A. 1mol N2(g)和1 mol O2(g)完全反应放出的能量为180 kJ
B. 通常情况下,N2(g)和O2(g)混合能直接生成NO
C. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的盐酸,丙为未知浓度的FeCl2溶液,试回答下列问题:
(1)甲溶液的pH=________。
(2)甲、乙、丙三种溶液中由水电离出的c(OH-)的大小关系为________。
(3)某化学兴趣小组认为在隔绝空气的环境中,用酸性KMnO4溶液能测定丙溶液的浓度(已知:5Fe2++MnO+8H+===5Fe3++Mn2++4H2O)。
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需________(填写仪器名称)。
②滴定实验要用到酸式滴定管或碱式滴定管,使用该仪器的第一步操作是_______。
③某同学设计的下列滴定方式中,最合理的是________(夹持部分略去,填字母序号),达到滴定终点的现象是__________________________。
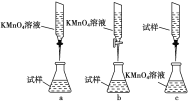
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
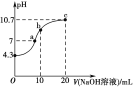
①写出H2N2O2在水溶液中的电离方程式:____________________________。
②c点时溶液中各离子浓度由大到小的顺序为_______________________________。
③b点时溶液中c(H2N2O2)________(填“>”“<”或“=”,下同)c(N2O![]() )。
)。
④a点时溶液中c(Na+)________c(HN2O)+c(N2O![]() )。
)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法错误的是
A.葡萄糖的分子式是C6H12O6B.葡萄糖在催化剂的作用下可水解
C.葡萄糖是人体重要的能量来源D.葡萄糖能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率,其反应速率最快的是
A. υ(D)=0.4 mol / (L·s)
B. υ(C)=0.5 mol / (L·s)
C. υ(B)=0.6 mol / (L·s)
D. υ(A)=0.15 mol / (L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com