
| A. | 2.7g金属铝变成铝离子时失去的电子数目为0.2NA | |
| B. | 16g CH4与18 g NH4+ 所含质子数相等 | |
| C. | 标准状况下,22.4 L汽油所含的分子数为NA | |
| D. | 在0℃,1.01×105Pa时,11.2L氮气所含的原子数目为NA |
分析 A、求出铝的物质的量,然后根据反应后铝变为+3价来分析;
B、求出两者的物质的量,然后根据铵根离子中含11个质子来分析;
C、标况下汽油为液体;
D、求出氮气的物质的量,然后根据氮气为双原子分子来分析.
解答 解:A、2.7g铝的物质的量为0.1mol,而反应后铝变为+3价,故0.1mol铝失去0.3mol电子即0.3NA个,故A错误;
B、16g甲烷的物质的量为1mol,18g铵根离子的物质的量也为1mol,甲烷中含10个质子,但铵根离子中含11个质子,故1mol甲烷中含10mol质子而铵根离子中含11mol质子,故B错误;
C、标况下汽油为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、标况下11.2L氮气的物质的量为0.5mol,而氮气为双原子分子,故0.5mol氮气中含1mol原子即NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 高铁酸钾处理水时,高铁酸钾发生还原反应 | |
| B. | 湿法中每生成1mol Na2FeO4共转移3mol电子 | |
| C. | 干法中每生成1mol Na2FeO4共转移4mol电子 | |
| D. | K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

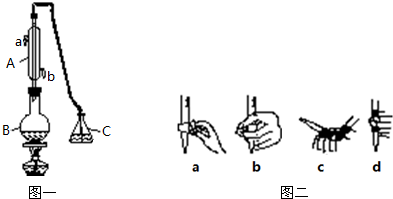
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
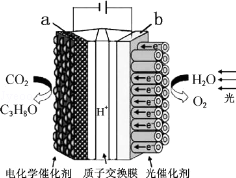 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成3mol O2,有88gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14.2克 Na2SO4含有的Na+离子数为0.2NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| C. | 通常状况下,NA个N2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 稀释浓硫酸时,应将浓硫酸倒入水中,边加边搅拌 | |
| C. | 用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| D. | 分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )
X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是亚硫酸钡 | B. | 洗气瓶中产生的沉淀是碳酸钡 | ||
| C. | 洗气瓶中没有明显现象 | D. | 洗气瓶中有硫酸钡沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com