
已知可逆反应CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
CO2(g)+H2(g)ΔH<0,反应达到平衡状态后,欲提高CO的转化率,可以采取的措施为
A.增大压强 B.升高温度 C.增大CO的浓度 D.分离出CO2
科目:高中化学 来源:2013-2014学年江苏省高三百校联合调研测试(一)化学试卷(解析版) 题型:填空题
已知X、Y、Z、W、K五种元素均位于周期表的前四周期,且原子序数依次增大。元素X是周期表中原子半径最小的元素;Y的基态原子中电子占据了三种能量不同的原子轨道,且这三种轨道中的电子数相同;W位于第2周期,其原子的核外成对电子数是未成对电子数的3倍;K位于ds区且原子的最外层电子数与X的相同。
请回答下列问题:(答题时,X、Y、Z、W、K用所对应的元素符号表示)
(1)Y、Z、W元素的第一电离能由大到小的顺序是 。
(2)K的电子排布式是 。
(3)Y、Z元素的某些氢化物的分子中均含有18个电子,则Y的这种氢化物的化学式是 ;Y、Z的这些氢化物的沸点相差较大的主要原因是
(4)若X、Y、W形成的某化合物(相对分子质量为46)呈酸性,则该化合物分子中Y原子轨道的杂化类型是 ;1 mol该分子中含有 σ键的数目是 。
(5)Z、K两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,Z原子的配位数是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:实验题
4,7-二甲基香豆素(熔点:132.6℃)是一种重要的香料,广泛分布于植物界中,由间甲苯酚为原料的合成反应如下:

实验装置图如下:

主要实验步骤:
步骤1.向三口烧瓶中加入60mL浓硫酸,并冷却至0℃以下,搅拌下滴入间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物。
步骤2.保持在10℃下,搅拌12h,反应完全后,将其倒入冰水混合物中,然后抽滤、水洗得粗品
步骤3.粗品用乙醇溶解并重结晶,得白色针状晶体并烘干,称得产品质量为33.0g。
(1)图中仪品名称:a ,b 。
(2)浓H2SO4需要冷却至0℃以下的原因是 。
(3)反应需要搅拌12h,其原因是 。
(4)确定最终产品是4,7-二甲基香豆素的实验或方法是 。
(5)本次实验产率为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年江苏省南京市、盐城市高三第一次模拟考试化学试卷(解析版) 题型:选择题
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,1.12LCCl4含有C-Cl键数目为0.2NA
B.标准状况下,2.24L氯气中含有的 Cl数目一定为0.2NA
Cl数目一定为0.2NA
C.常温常压下,4.4gCO2与N2O混合气体中含有的原子总数为0.3NA
D.80mL 10mol·L-1 盐酸与足量MnO2加热反应,产生Cl2分子数为0.2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省韶关市高三4月高考二模理综化学试卷(解析版) 题型:填空题
醋酸是中学常用的一种弱酸。
(1)取0.10mol CH3COOH作导电性实验,测得其导电率随加入的水量变化如图所示:

①开始时导电率为0说明: 。
② 比较a、b点的相关性质(填“>”、“<”、“=”):n(H+):a b;c(CH3COO-):a b;完全中和时消耗NaOH的物质的量:a b;
③若b点时,溶液中c(CH3COOH)=0.10mol/L,c(H+)=1.3×10-3mol/L,则此时c(CH3COO-)约为 mol/L;计算b点时醋酸的电离平衡常数,写出计算过程 。
(2)已知:H+(aq) + OH-(aq) = H2O(l) △H1=-57.3 kJ/mol
CH3COOH(aq)  H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
H+(aq) +CH3COO-(aq) △H2=+1.3 kJ/mol
写出稀醋酸与稀烧碱溶液反应的热化学方程式: 。
(3)室温下,取浓度均为0.10mol/L的醋酸与醋酸钠溶液等体积混合后,测得其pH<6,写出混合溶液中的物料守恒关系式 ;并列出其中的离子浓度大小顺序(由大到小) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:实验题
氨水是一种的常用的化学试剂。
(1)以浓氨水和生石灰为原料,用如下装置为发生装置,可制取少 量氨气。已知:NH3·H2O+CaO=Ca(OH)2+NH3↑。

①生石灰应该装在 (填A或B)。
②试从电离平衡角度分析该实验中氨气逸出的原因: 。
③现要用试管和必要实验用品收集一试管氨气,请在C处补充相应收集装置。
(2)化学兴趣小组用氨水与硝酸银溶液配制好银氨溶液后,进行乙醛的银镜反应实验,但部分同学实验时间长,且效果不明显。影响乙醛银镜反应速率的因素有哪些呢?请你完成如下猜想:
①猜想:因素一:银氨溶液的pH大小;
因素二: 。
②你设计实验验证上述影响因素一,完成下表中内容。
提供试剂:乙醛、2%稀氨水、 0.25mol/L NaOH溶液、盐酸 、 2% AgNO3溶液
实验用品:烧杯(装有热水)、试管
实验步骤 | 实验操作 | 预期现象及结论(步骤1只填现象) |
1 | 在A、B两支洁净的试管中各入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至最初产生的沉淀恰好完全溶解,此时制得pH均约为8的银氨溶液。 |
|
2 |
|
|
(3)吸取20.00ml 上述氨水于锥形瓶,滴加3滴甲基橙指示剂,用0.0050mol/L标准硫酸滴定,滴定至出现红色为终点,重复3次实验,平均消耗标准硫酸20.04 ml,计算上述氨水的物质的量浓度
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省茂名市高三第二次高考模拟理综化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,44 g CO2含有nA个C原子
B.1 L 0.1 mol·L-1 Na2S溶液中含有0.1 nA个S2—
C.0.1 mol Na与足量O2反应,转移0.2 nA个电子
D.标准状况下,22.4 L 的CCl4含有4 nA个Cl原子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省潮州市高三第二次模拟考试理综化学试卷(解析版) 题型:实验题
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ. AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4溶液。
⑴请完成下表:
操作 | 现象 | 结论 |
取少量除尽Ag+后的溶液于试管中,加入 ,振荡 |
| 存在Fe3+ |
取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4溶液,振荡 |
| 存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
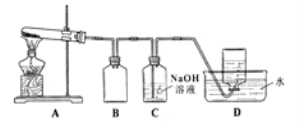
Ⅱ.⑵装置B的作用是 。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:① Ag;② Ag2O;③ Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
实验编号 | 操作 | 现象 |
a | 加入足量氨水,振荡 | 黑色固体不溶解 |
b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】取2.0g AgNO3样品充分受热分解,共收集到标况下气体的体积为336mL,则样品中AgNO3的百分含量为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省惠州市高三4月模拟考试理综化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.NaHCO3和Na2CO3混合溶液中:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.常温下,浓度均为0.1 mol·L-1下列各溶液的pH:NaOH>Na2CO3> NaHCO3> NH4Cl
C.向冰醋酸中逐滴加水,醋酸的电离程度、pH均先增大后减小
D.常温下,pH=1的稀硫酸与醋酸溶液中,c (SO42-)与c(CH3COO-)之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com