
【题目】下列热化学方程式中ΔH代表燃烧热的是 ( )
A. CH4(g)+![]() O2(g)===2H2O(l)+CO(g) ΔH1
O2(g)===2H2O(l)+CO(g) ΔH1
B. H2(g)+![]() O2(g)===H2O(g) ΔH2
O2(g)===H2O(g) ΔH2
C. C2H5OH(l)+3O2(g)===2CO2(g)+3H2O(l) ΔH3
D. 2CO(g)+O2(g)===2CO2(g) ΔH4
科目:高中化学 来源: 题型:
【题目】反应CH2=CH2+ H2→CH3-CH3 , 有关化学键的键能如下: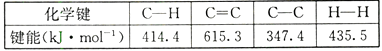
则该反应的反应热△H为( )
A.+288.8kJ/mo1
B.-703.4 kJ/mo1
C.+125.4kJ/mo1
D.-125.4 kJ/mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)I.已知:Na2S2O3 + H2 SO4=Na2SO4 + SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验:
实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
①该实验①、②可探究温度对反应速率的影响,因此V1= , V2 = , V3=;
(2)②若V4=10.0,V5=6.0,则实验①、③可探究 对反应速率的影响。
(3)Ⅱ.利用反应:I2+2Na2S2O3=Na2S4O6+2NaI可定量测定硫代硫酸钠(Mr=158)的纯度,现在称取wg硫代硫酸钠固体样品,配成250 mL的溶液,取25.00 mL置于锥形瓶中,加入指示剂,用a mol/L的碘水滴定,消耗碘水b mL,则:
①滴定应选择的指示剂是 , 滴定终点的现象为。
②对于该滴定实验的有关操作或误差分析正确的是。
A.滴定前,要用对应装入的溶液润洗滴定管和锥形瓶
B.滴定过程中,标准液滴到锥形瓶外,会使所测得的结果偏大
C.滴定开始时滴定管尖嘴有气泡,滴定结束后气泡消失,测得纯度将偏小
D.滴定前仰视读数而滴定结束时俯视读数,则所测得的纯度将会偏小
③样品中硫代硫酸钠纯度的表达式为。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A. 固体SiO2一定是晶体
B. 晶体有固定的组成,非晶体没有固定的组成
C. 晶体内部的微粒按一定规律呈周期性有序排列
D. 冰和固体碘晶体中相互作用力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷是人体含量较多的元素之一,磷的化合物在药物生产和农药制造等方面用途非常广泛。回答下列问题:
(1)基态磷原子的核外电子排布式为____________________。
(2)P4S3可用于制造火柴,其分子结构如图甲所示。
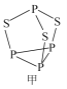
①第一电离能:磷_____________硫;电负性:磷_____________硫(填“>”或“<”)。
②P4S3分子中硫原子的杂化轨道类型为_____________。
③每个P4S3分子中含孤电子对的数目为______________。
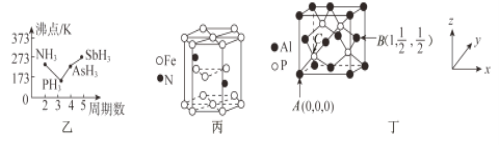
(3)N、P、As、Sb均是第VA族的元素。
①上述元素的氢化物的沸点关系如图乙所示,沸点:PH3<NH3,其原因是____________________;沸点:PH3<AsH3<SbH3,其原因是_____________________________________________________。
②某种磁性氮化铁的晶胞结构如图丙所示,该化合物的化学式为_________________。
(4)磷化铝熔点为2000℃,它与晶体硅互为等电子体,磷化铝晶胞结构如图丁所示。
①图中A点和B点的原子坐标参数如图丁所示,则C点的原子坐标参数为_______________。
②磷化铝晶体的密度为ρg·cm-3用NA表示阿伏加德罗常数的数值,则该晶胞中距离最近的两个铝原子之间的距离为_____________________________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用括号内试剂除去下列各物质中的少量杂质,正确的是( )
A.溴苯中的溴(苯)
B.甲烷中的乙烯(溴水)
C.乙醇中的水(金属钠)
D.甲烷中的乙烯(酸性高锰酸钾溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验中安全意识是重要的科学素养,下列行为中符合安全要求的是( )
A.进入煤矿井时,用火把照明B.节日期间,在开阔的广场燃放烟花爆竹
C.实验时,将水倒入浓硫酸配制稀硫酸D.用点燃的火柴在液化气钢瓶口检验是否漏气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是某学生绘制的实验室分馏石油的装置图:
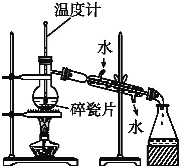
(1)实验室分馏石油的正确操作顺序是E→___→ →A→C→ → 。
A.连接接液管
B.装入碎瓷片(沸石)和石油,塞上带温度计的塞子
C.检查装置气密性
D.连接冷凝管及进出水管
E.在铁架台上放酒精灯,固定好铁圈,放上石棉网
F.固定好蒸馏烧瓶,调节好温度计的位置
G.加热
(2)装置图中有两处错误,它们分别是:
①冷凝管中进水口和出水口接反了;
②______________________________________________________。
Ⅱ. 由石油裂化和裂解得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:
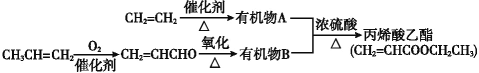
根据以上材料和你所学的化学知识回答下列问题:
(3)由![]() 制得有机物A的化学方程式是________________,反应类型是___。
制得有机物A的化学方程式是________________,反应类型是___。
(4)由A与B合成丙烯酸乙酯的化学方程式是______________________,反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室按照图1所示装置制备氯酸钾、氯水并进行有关探究实验。
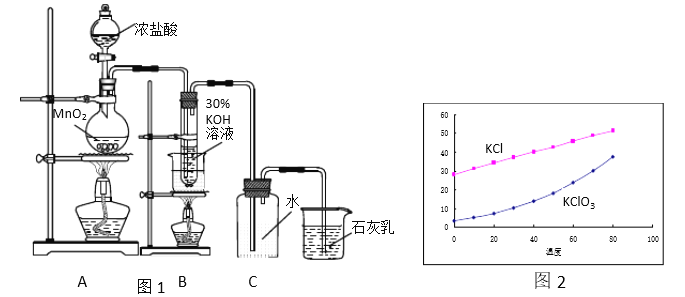
Ⅰ实验一 制取氯酸钾和氯水
(1)A中发生反应的化学方程式是_____________。
(2)制备KClO3需在70℃~80℃进行,写出制备KClO3的离子方程式______。
(3)装置C的作用是_____ 。
(4)KCl 和KClO3的溶解度如图2所示。反应结束后,将装置B中的溶液放到冰水浴中, 20秒后会析出较多晶体X。这样做是因为________(选填a、b、c):
a. KClO3溶解度受温度影响较大而KCl溶解度受温度影响较小
b. 0℃时,KClO3溶解度比KCl小
c. 溶液中的溶质主要是KClO3
所以在冷却过程中晶体X会沉淀析出,X的化学式是_______。
(5)上一步操作会不可避免地使另一种物质同时析出,因此要获得较纯净的X,需要进行的具体的操作步骤是_________________。
Ⅱ实验二 氯酸钾性质研究
(6)在不同条件下KClO3可将KI氧化为不同的产物。该小组设计了如下实验,研究反应条件对反应产物的影响(实验在室温下进行):
0.20 mol·L KI/ mL | KClO3(s) /g | 6.0 mol·L-1 H2SO4/ mL | 蒸馏水/ mL | |
试管1 | 1.0 | 0.10 | 0 | 9.0 |
试管2 | 1.0 | 0.10 | 3.0 | 6.0 |
①该实验的实验目的是__。
②设计试管1实验的作用是_____。
③实验后发现,试管2中产生黄色溶液,该同学预测KI被氧化为I2。用离子方程式表示该同学的预测____________;请设计2种实验方案验证该预测正确(从加入试剂、现象、结论等方面描述)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com