
| 实验过程 | 预期现象 | 实际观察到的现象 |
| a取已切去表皮的一小块金属钠,放入盛有水的某容器中 | 立即剧烈反应 | 开始时钠块浮在水面上不反应,稍后才开始与水剧烈反应 |
| b向盛有适量水(内含2滴 酚酞的试管中加入一小段镁条 | 有气泡产生,溶液变红色 | 没有相应现象,加热后仍无明显变化 |
| c向两支盛有3mL6mol·L-1盐酸的试管中加入大小相同的镁片和铝片 | 镁、铝与盐酸反应产生气泡剧烈程度不同 | 镁与盐酸反应产生气泡速率较快 |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源:不详 题型:单选题
| A.镭比钙的金属性更强 | B.在化合价中呈+2价 |
| C.镭是一种放射性元素 | D.氢氧化镭呈两性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1s22s22p63s13p3 | B.1s22s22p63s23p63d104s14p1 |
| C.1s22s22p63s23p63d24s1 | D.1s22s22p63s23p63d104s24p1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
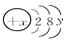
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
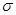 ”“
”“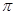 ”)。
”)。| 化学键 | N-N | N=N | N≡N | N-H | H-H |
| 键能/kJ?mol-1 | 159 | 418 | 946 | 391 | 436 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相 关 信 息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为倍受青睐的清洁燃料。 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障。 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂。 |
| D | 室温下其单质呈粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰。 |
| E | 它是人体不可缺少的微量元素,其单质也是工业生产中不可缺少的金属原材料,常用于制造桥梁、轨道等。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com