
【题目】有机物W(C16H14O2)用作调香剂、高分子材料合成的中间体等,制备W的一种合成路线如下:

已知:
请回答下列问题
(1)F的化学名称是______,⑤的反应类型是______。
(2)E中含有的官能团是_____(写名称),E在一定条件下聚合生成高分子化合物,该高分子化合物的结构简式为______。
(3)E + F→W反应的化学方程式为_____。
(4)与A含有相同官能团且含有苯环的同分异构体还有____种(不含立体异构),其中核磁共振氢谱为六组峰,且峰面积之比为1∶1∶2∶2∶2∶2∶2的结构简式为_____。
【答案】苯甲醇 消去反应 碳碳双键、羧基 
![]() +
+![]()
![]()
![]() +H2O 5
+H2O 5 ![]()
【解析】
根据A到B的反应条件可知该过程发生碳碳双键的加成反应,由B的结构简式可知A为![]() ;B发生水解反应生成C为
;B发生水解反应生成C为![]() ,C催化氧化的产物继续氧化生成D(其中一个羟基所连碳原子上没有氢原子,不能被氧化),则D为
,C催化氧化的产物继续氧化生成D(其中一个羟基所连碳原子上没有氢原子,不能被氧化),则D为![]() ;对比D、E分子式可知D分子内脱去1分子水生成E,故D在浓硫酸、加热条件下发生消去反应生成E,则E为
;对比D、E分子式可知D分子内脱去1分子水生成E,故D在浓硫酸、加热条件下发生消去反应生成E,则E为![]() ,E与F发生酯化反应生成W为
,E与F发生酯化反应生成W为![]() 。
。
(1)F为![]() ,名称为苯甲醇;⑤为卤代烃的消去反应;
,名称为苯甲醇;⑤为卤代烃的消去反应;
(2)E为![]() ,官能团为碳碳双键和羧基;E中含有碳碳双键所以可以发生加聚反应生成高聚物,高聚物的结构简式为
,官能团为碳碳双键和羧基;E中含有碳碳双键所以可以发生加聚反应生成高聚物,高聚物的结构简式为 ;
;
(3)E和F发生酯化反应生成W,化学方程式为![]() +
+![]()
![]()
![]() +H2O;
+H2O;
(4)A为![]() ,其同分异构体含有相同的官能团,即碳碳双键,若含有1个侧链,还可以为—CH=CHCH3或—CH2CH=CH2,若含有2个侧链则为—CH3、—CH=CH2,有邻、间、对3种位置结构,故符合条件的同分异构体还有2+3=5种,其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为:
,其同分异构体含有相同的官能团,即碳碳双键,若含有1个侧链,还可以为—CH=CHCH3或—CH2CH=CH2,若含有2个侧链则为—CH3、—CH=CH2,有邻、间、对3种位置结构,故符合条件的同分异构体还有2+3=5种,其中核磁共振氢谱为六组峰,且峰面积之比为1:1:2:2:2:2的结构简式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某同学用10 mol/L的浓盐酸配制250mL 1 mol/L的稀盐酸,并进行有关实验。请回答下列问题:
(1)需要量取浓盐酸______mL。
(2)配制该稀盐酸时使用的仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_____、_____等。
(3)取所配制的稀盐酸100mL,与一定质量的锌充分反应,锌全部溶解后,生成的气体在标准状况下的体积为0.896L,则参加反应的锌的质量为_____g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是
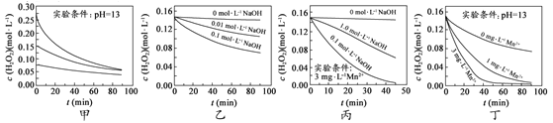
A.图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
D.图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H等8种物质存在如下转化关系(反应条件,部分产物为标出).已知: A 是酸式盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题:

(1)写出下列物质的化学式:A________,B________,写出B的一种危害__________。
(2)写出下列反应的化学方程式:E→F____________;红热的木炭与D的浓溶液反应的方程式:____________;铜与H的浓溶液反应的离子方程式:_____________。
(3)检验某溶液中是否含A 中阳离子的方法_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,碳钢腐蚀与溶液pH的关系如下:
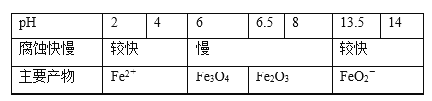
下列说法不正确的是( )
A.在pH<4溶液中,碳钢主要发生析氢腐蚀
B.在pH>6溶液中,碳钢主要发生吸氧腐蚀
C.在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e-=2H2O
D.在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z都是短周期的元素,它们的原子序数依次递增。X原子的电子层数与它的核外电子总数相同,而Z原子的最外层电子数是次外层电子数的三倍,Y和Z可以形成两种以上气态化合物,则
(1)X是____________、Y是___________、Z是__________。
(2)由Y和Z组成,且Y和Z质量比为7∶20的化合物的化学式(分子式)是______。
(3)X、Y、Z可以形成一种盐,此盐中X、Y、Z元素的原子的个数比为4∶2∶3,该盐的化学式(分子式)是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的离子方程式。
①酸性KMnO4溶液和草酸(H2C2O4)溶液反应_____。
②硫代硫酸钠与稀硫酸反应_____。
③用硫氰化钾溶液检验Fe3+_____。
(2)利用电解技术,以氯化氢为原料回收氯气的过程如图所示,回答下列问题:H+由_____极区向_____极区迁移(填阴、阳);阳极电极反应式:____;阴极电极反应式:______。

(3)燃料种类很多,如氢氧燃料电池(如KOH为电解液)。写出该电池电极反应式正极:______;负极:_____。
(4)氯碱工业原理的化学方程式:______。如图为用阳离子交换膜法进行该工业生产的装置示意图,标出a~f处所对应的原料或产品:_____。

生成0.4kg烧碱时,转移电子的物质的量是____mol。(相对原子质量Na-23、H-1、O-16)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质:(用序号填空)
① O2和O3 ; ②12C 与14C; ③ CH3 (CH2) 3 CH3和![]()
④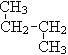 和
和![]() ;
;
(1)互为同位素的是_______ ;(2)互为同素异形体的是________;
(3)互为同分异构体的是________;(4)属于同一物质的是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com