
分析 (1)核电荷数比As小4的原子为Cu,其原子核外有29个电子,根据构造原理书写其基态原子核外电子排布式;
(2)按照从第一到第四周期的顺序,根据元素周期表中各元素结构及未成对电子数进行解答;
(3)类比NH3可推知NCl3中心原子杂化方式为sp3杂化,NCl3的空间构型为三角锥形;
(4)依据题干信息“它们的晶体结构与单晶硅相似”,通过硅类推AlN的晶体类型为原子晶体;
(5)根据NaCl的摩尔质量为Mr g•mol-1及密度为ρ g•cm-3,求得晶胞的体积,进而求得棱边长,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半.
解答 解:(1)核电荷数比As小4的原子为Cu,其原子核外有29个电子,基态的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;
故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;
(2)第一周期中,有1个未成对电子的是氢原子,其电子排布式为1s1;第二周期中,未成对电子是2个的有两种分别为:C:1s22s22p2和O:1s22s22p4;第三周期中,未成对电子是3个的是P:1s22s22p63s23p3;第四周期中未成对电子是4个的是Fe:1s22s22p63s23p63d64s2,
故答案为:5;
(3)NH3中心原子杂化方式为sp3杂化,NH3的空间构型为三角锥形,类比NH3可推知NCl3中心原子杂化方式为sp3杂化,NCl3的空间构型为三角锥形;
故答案为:sp3杂化;三角锥形;
(4)依据题干信息“它们的晶体结构与单晶硅相似”,通过硅类推AlN的晶体类型为原子晶体,每个Al原子与4个N原子相连,故答案为:4;原子;
(5)设晶胞边长为a,在NaCl晶胞中,含4个Cl-,含4个Na+,根据密度公式ρ=$\frac{\frac{4Mr}{{N}_{A}}}{{a}^{3}}$,可得a=$\root{3}{\frac{4{M}_{r}}{ρN{\;}_{A}}}$,所以晶胞面对角线长为$\sqrt{2}$×$\root{3}{\frac{4{M}_{r}}{ρN{\;}_{A}}}$,而两个距离最近的钠离子中心间的距离等于晶胞面对角线的一半,所以两个距离最近的钠离子中心间的距离为$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4{M}_{r}}{ρN{\;}_{A}}}$,故答案为:$\frac{\sqrt{2}}{2}$×$\root{3}{\frac{4{M}_{r}}{ρN{\;}_{A}}}$.
点评 本题考查了核外电子排布、分子构型和杂化方式、晶胞的计算等内容,综合性较强,难度中等,解题的关键要充分用好立体几何的知识,发挥空间想象力,解决问题.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
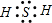 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )
某温度下,体积和pH都相同的稀硫酸和硫酸铝溶液加水稀释时的pH变化曲线如图,下列有关说法正确的是( )| A. | 加等量的水后硫酸中水电离出的C(H+)与硫酸铝中水电离出的C(H+)的比值比稀释前的比值增大 | |
| B. | a点溶液中有:c(H+)+c(Al3+)=c(OH-)+c(SO42-) | |
| C. | 体积和pH都相同的稀硫酸和硫酸铝溶液与等浓度的NaOH反应,消耗NaOH的体积相等 | |
| D. | b、c两溶液水电离出的c(OH-)相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 标准状况下,22.4 L氧气作氧化剂时转移电子数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2溶液中加入足量的Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH-=CaCO3↓+BaCO3↓+2H2O | |
| B. | 3molCl2通入含2molFeI2的溶液中:2Fe2++4I-+3Cl2=2Fe3++6Cl-+2I2 | |
| C. | 往Ba(OH)2溶液中逐滴加入NH4Al(SO4)2溶液,可能发生反应的离子方程式是Al3++SO42-+Ba2++3OH-=BaSO4↓+Al(OH)3↓ | |
| D. | 向苯酚钠溶液中通入少量的CO2: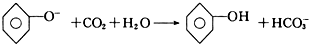 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 含有共价键的化合物就是共价化合物 | |
| C. | 含有离子键的化合物就是离子化合物 | |
| D. | 多种非金属元素之间形成的共价键一定是极性键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com