
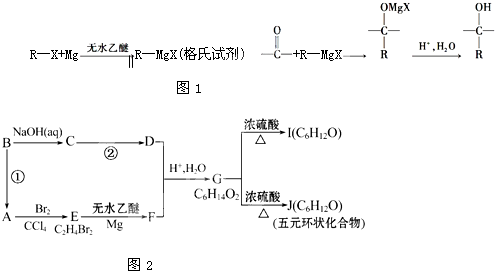
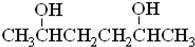 ,J为五元环状化合物,应是G中两个羟基脱出一分子水所得产物
,J为五元环状化合物,应是G中两个羟基脱出一分子水所得产物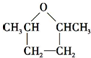 (类似浓硫酸使乙醇脱水生成乙醚),对比G、I的分子式可知,I为G在浓硫酸作用下发生消去反应的产物,则I为CH3CH(OH)CH2CH=CHCH3或CH3CH(OH)CH2CH2CH=CH2,据此解答.
(类似浓硫酸使乙醇脱水生成乙醚),对比G、I的分子式可知,I为G在浓硫酸作用下发生消去反应的产物,则I为CH3CH(OH)CH2CH=CHCH3或CH3CH(OH)CH2CH2CH=CH2,据此解答.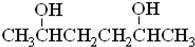 ,J为五元环状化合物,应是G中两个羟基脱出一分子水所得产物
,J为五元环状化合物,应是G中两个羟基脱出一分子水所得产物 (类似浓硫酸使乙醇脱水生成乙醚),对比G、I的分子式可知,I为G在浓硫酸作用下发生消去反应的产物,则I为CH3CH(OH)CH2CH=CHCH3或CH3CH(OH)CH2CH2CH=CH2,
(类似浓硫酸使乙醇脱水生成乙醚),对比G、I的分子式可知,I为G在浓硫酸作用下发生消去反应的产物,则I为CH3CH(OH)CH2CH=CHCH3或CH3CH(OH)CH2CH2CH=CH2,| 催化剂 |
| △ |
| 催化剂 |
| △ |
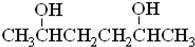 ,G的最简单的同系物的名称是OHCH2CH2OH,名称是乙二醇,故答案为:
,G的最简单的同系物的名称是OHCH2CH2OH,名称是乙二醇,故答案为: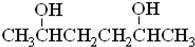 ;乙二醇;
;乙二醇;

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
| A、a>b | B、a<b |
| C、a=b | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
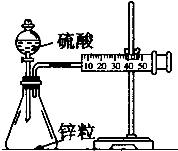 I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸 溶液 | MnSO4固体 | 0.10mol/L KMnO4溶液 | 褪色 时间 |
| 1 | 750C | 一 | 一 | 1mL | 100s |
| 2 | 750C | 10滴 | 一 | 1mL | 40s |
| 3 | 750C | 10滴 | 加入少许 | 1mL | 3s |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(min) | 1 | 2 | 3 | 4 | 5 | 6 |
| 氢气体积(mL) | 50 | 120 | 224 | 392 | 472 | 502 |
查看答案和解析>>
科目:高中化学 来源: 题型:
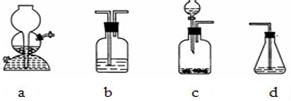 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.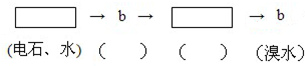
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入5mL盐酸进行滴定 |
| B、返滴一滴待测盐酸 |
| C、重新进行滴定 |
| D、以上方法均不适用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | |||
| 实验 |  |  |  |
| 实验结论 | 结论: | ||
| 反应方程式 | |||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验步骤 | 预期现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中,振荡后加入CCl4,振荡、静置 | (1)溶液分层,上层几乎无色,下层为橙色. (2) | (1) (2) |
| 2.将少量溴水加入盛有NaI溶液的试管中,振荡后加入少量CCl4,振荡、静置 | (3) | |
| 实验结论并从原子结构上 解释原因 | 结论: 原因: | |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,应立即用大量的水冲洗 |
| C、加热试管或烧杯时,应首先擦干外壁上的水 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO4(s) |
| B、H2O |
| C、K2SO4溶液 |
| D、4mol/L H2SO4? |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com