
| A、活化分子之间的碰撞不一定都是有效碰撞 |
| B、升高温度,可使单位体积内活化分子数增多,反应速率加快 |
| C、催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 |
| D、对于有气体参加的反应增大压强,可使单位体积内活化分子百分数增加,反应速率加快 |


科目:高中化学 来源: 题型:
| A、化学变化中一定伴随着能量变化,伴随着能量变化的过程都是化学变化 |
| B、化石燃料和植物燃料燃烧时放出的能量均来自于太阳能 |
| C、光合作用中所发生的化学反应,反应物的总能量小于生成物的总能量 |
| D、放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、如图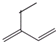 有机化合物主链5个C原子 有机化合物主链5个C原子 |
B、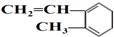 与Br2发生1:1加成反应的产物有6种 与Br2发生1:1加成反应的产物有6种 |
| C、苯的结构比较稳定,发生取代反应相对比较容易,发生苯环结构被破坏的加成反应困难得多,而氧化反应不能发生 |
D、丁苯橡胶结构如下,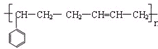 其单体均为烯烃 其单体均为烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴化亚铁溶液与少量氯水混合:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
| B、向NaAlO2溶液中通入过量的CO2有白色沉淀:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |
| C、漂白液和强酸性洗涤剂混合使用:Cl-+ClO-+2H+=Cl2↑+H2O |
| D、少量碳酸氢镁与Ca(OH)2悬浊液混合:Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、S(s)的能量高于SO2(g)的能量 |
| B、S(s)和O2(g)的总能量大于SO2(g)的能量 |
| C、若有S(g)+O2(g)=SO2(g)△H2,则△H2>△H1 |
| D、形成1mol SO2(g)的化学键释放的总能量比断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量多297.23kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl- |
| B、向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42- |
| C、向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32 |
| D、把H2O2滴入FeCl2溶液中,溶液由浅绿色变为棕黄色,证明H2O2有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②⑤ | B、②③⑥ |
| C、①②④ | D、②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | SiHCl3 | SiCl4 | AsCl3 |
| 沸点/℃ | 32.0 | 57.5 | 131.6 |
| 一定条件 |
| n(SiHCl3) |
| n(H2) |
| 催化剂 |
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com