
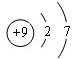 £®
£®·ÖĪö £Ø1£©ÓėĀČŌŖĖŲĶ¬×åµÄ¶ĢÖÜĘŚŌŖĖŲĪŖF£»
£Ø2£©Ķ¬Ņ»Ö÷×åŌŖĖŲ£¬ŌŖĖŲµÄ·Ē½šŹōŠŌĖę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õČõ£¬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ĘäĘųĢ¬Ēā»ÆĪļŌ½ĪČ¶Ø”¢Ę䵄֏µÄŃõ»ÆŠŌŌ½Ē攢Ęä×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļĖįŠŌŌ½Ē攢ÓėĒāĘų»ÆŗĻŌ½ČŻŅ×£»
£Ø3£©¢Łµē½āŹ±£¬Ńō¼«ÉĻĀČĄė×ӷŵēÉś³ÉĀČĖįøłĄė×Ó”¢Ņõ¼«ÉĻĒāĄė×ӷŵēÉś³ÉĒāĘų£»
¢Ś¹¤ŅµÉĻ£¬ĶعżČēĻĀ×Ŗ»ÆæÉÖʵĆKClO3¾§Ģå£ŗNaClČÜŅŗNaClO3ČÜŅŗKClO3¾§Ģ壬µē½āŹ±£¬Ńō¼«ÉĻĀČĄė×ӷŵēÉś³ÉĀČĖįøłĄė×Ó”¢Ņõ¼«ÉĻĒāĄė×ӷŵēÉś³ÉĒāĘų£»Į½ÖÖ»ÆŗĻĪļĻą»„½»»»³É·ÖÉś³ÉĮķĶāµÄĮ½ÖÖ»ÆŗĻĪļµÄ·“Ó¦ĪŖø“·Ö½ā·“Ó¦£¬ĻąĶ¬ĪĀ¶ČĻĀ£¬Čܽā¶ČŠ”µÄĪļÖŹĻČĪö³ö£®
½ā“š ½ā£ŗ£Ø1£©ÓėClĶ¬Ņ»Ö÷×åŹĒ¶ĢÖÜĘŚŌŖĖŲŹĒFŌŖĖŲ£¬FŌ×ÓŗĖĶāÓŠ2øöµē×Ó²ć”¢×īĶā²ć7øöµē×Ó£¬ĘäŌ×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ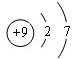 £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ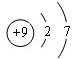 £»
£»
£Ø2£©Ķ¬Ņ»Ö÷×åŌŖĖŲ£¬ŌŖĖŲµÄ·Ē½šŹōŠŌĖę×ÅŌ×ÓŠņŹżŌö“ó¶ų¼õČõ£¬ŌŖĖŲµÄ·Ē½šŹōŠŌŌ½Ē棬ĘäĘųĢ¬Ēā»ÆĪļŌ½ĪČ¶Ø”¢Ę䵄֏µÄŃõ»ÆŠŌŌ½Ē攢Ęä×īøß¼ŪŃõ»ÆĪļµÄĖ®»ÆĪļĖįŠŌŌ½Ē攢ÓėĒāĘų»ÆŗĻŌ½ČŻŅ×£¬
¹Ź“š°øĪŖ£ŗbc£»
£Ø3£©¢Łµē½āŹ±£¬Ńō¼«ÉĻĀČĄė×ӷŵēÉś³ÉĀČĖįøłĄė×Ó”¢Ņõ¼«ÉĻĒāĄė×ӷŵēÉś³ÉĒāĘų£¬ĖłŅŌ·“Ó¦·½³ĢŹ½ĪŖNaCl+3H2O$\frac{\underline{\;µē½ā\;}}{\;}$NaClO3+3H2”ü£¬
¹Ź“š°øĪŖ£ŗ1£»3£»1£»3£»H2£»
¢ŚNaClO3×Ŗ»ÆĪŖKClO3£¬ĖµĆ÷øĆ·“Ó¦ÖŠĮ½ÖÖĪļÖŹĻą»„½»»»Ąė×ÓÉś³ÉŃĪ£¬ĪŖø“·Ö½ā·“Ó¦£¬ĻąĶ¬ĪĀ¶ČĻĀ£¬Čܽā¶ČŠ”µÄĪļÖŹĻČĪö³ö£¬ŹŅĪĀĻĀKClO3ŌŚĖ®ÖŠµÄČܽā¶ČĆ÷ĻŌŠ”ÓŚĘäĖü¾§Ģ壬ĖłŅŌĻČĪö³öKClO3£¬
¹Ź“š°øĪŖ£ŗø“·Ö½ā·“Ó¦£»ŹŅĪĀĻĀ£¬KClO3ŌŚĖ®ÖŠµÄČܽā¶ČĆ÷ĻŌŠ”ÓŚĘäĖü¾§Ģ壮
µćĘĄ ±¾Ģāæ¼²é½Ļ×ŪŗĻ£¬Éę¼°Ķ¬Ņ»ÖÜĘŚÖŠŌŖĖŲÖÜĘŚĀÉÓėŌ×Ó½į¹¹µÄ¹ŲĻµ”¢»Æѧ·½³ĢŹ½µÄŹéŠ“”¢Ńõ»Æ»¹Ō·“Ó¦¼ĘĖćµČÖŖŹ¶£¬×¢ÖŲøßĘµæ¼µćµÄ漲飬ĢāÄæÄŃ¶Č½Ļ“ó£¬ÓŠĄūÓŚÅąŃųѧɜµÄ·ÖĪö”¢Ąķ½āÄÜĮ¦¼°Įé»īÓ¦ÓĆĖłŃ§ÖŖŹ¶µÄÄÜĮ¦£®


 Õć½ĆūŠ£ĆūŹ¦½š¾ķĻµĮŠ“š°ø
Õć½ĆūŠ£ĆūŹ¦½š¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŗ¬5øöĢ¼Ō×ÓµÄÓŠ»śĪļ£¬Ćæøö·Ö×ÓÖŠ×ī¶ąæÉŠĪ³É4øöC-C¼ü | |
| B£® | ÕżĪģĶé·Ö×ÓÖŠĖłÓŠŌ×Ó¾łŌŚŅ»ĢõÖ±ĻßÉĻ | |
| C£® | Ģ¼Ģ¼¼äŅŌµ„¼ü½įŗĻ£¬Ģ¼Ō×ÓŹ£Óą¼Ū¼üČ«²æÓėĒāŌ×Ó½įŗĻµÄĢžŅ»¶Ø·ūŗĻĶØŹ½CnH2n+2 | |
| D£® | ·Ö×ÓŹ½ĪŖC3H8ÓėC6H14µÄĮ½ÖÖÓŠ»śĪļŅ»¶Ø»„ĪŖĶ¬ĻµĪļ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĶʶĻĢā
 CCH3CH2OHD
CCH3CH2OHD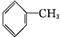 ECH3COOH
ECH3COOH
 CH3COOCH2CH3+H2O£®
CH3COOCH2CH3+H2O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ³£ĪĀ³£Ń¹ĻĀ1molO2ÓėĘäĖūĪļÖŹ·¢Éś·“Ó¦Ź±×ŖŅʵĵē×ÓŹżŅ»¶ØĪŖ4NA | |
| B£® | 1L 0.1 mol/LµÄNa2CO3ČÜŅŗÖŠ£¬Na+”¢CO32-×ÜŹżĪŖ0.3 NA | |
| C£® | 28g C18OÖŠŗ¬ÓŠµÄÖŹ×ÓŹżĪŖ14 NA | |
| D£® | ŠæÓėŅ»¶ØÅØ¶ČµÄÅØĮņĖį·“Ó¦£¬²śÉś±ź×¼×“æöĻĀSO2ŗĶH2µÄ»ģŗĻĘųĢå22.4L£¬ŠæŹ§Č„µē×ÓŹżĪŖ2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CuSO4 | B£® | FeCl3 | C£® | HCl | D£® | H2SO4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | N2”¢H2¾łĪŖ0.18mol/L | B£® | N2ĪŖ0.15mol/L | ||
| C£® | N2ĪŖ0.2mol/L£¬H2ĪŖ0.6mol/L | D£® | NH3ĪŖ0.4mol/L |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
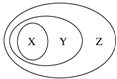 Čē±ķĖłĮŠĪļÖŹ»ņøÅÄī¼äµÄ“ÓŹō¹ŲĻµ·ūŗĻČēĶ¼ĖłŹ¾¹ŲĻµµÄŹĒ£Ø””””£©
Čē±ķĖłĮŠĪļÖŹ»ņøÅÄī¼äµÄ“ÓŹō¹ŲĻµ·ūŗĻČēĶ¼ĖłŹ¾¹ŲĻµµÄŹĒ£Ø””””£©| Ń”Ļī | X | Y | Z |
| A | ¹āµ¼ĻĖĪ¬ | ĖįŠŌŃõ»ÆĪļ | “«Ķ³ĪŽ»ś·Ē½šŹō²ÄĮĻ |
| B | “æ¼ī | ¼ī | »ÆŗĻĪļ |
| C | Ńõ»ÆĪļ | »ÆŗĻĪļ | “æ¾»Īļ |
| D | H2SO4 | ŗ¬ŃõĖį | ĒæĖį |
| A£® | A | B£® | B | C£® | C | D£® | D |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĀČ»ÆÄĘČÜŅŗ | B£® | ½šŹōĶ | C£® | ¶žŃõ»ÆĮņ | D£® | ĮņĖįĶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·“Ó¦A£Øg£©+B£Øg£©ØT2C£Øs£©æÉŅŌ×Ō·¢½ųŠŠ£¬ŌņĘä±ŲĪŖ·ÅČČ·“Ó¦ | |
| B£® | “ÓC£ØŹÆÄ«£¬s£©ØTC£Ø½šøÕŹÆ£¬s£©”÷H=+1.9 kJ/mol£¬æÉÖŖ£ŗ½šøÕŹÆ±ČŹÆÄ«øüĪČ¶Ø | |
| C£® | µČÖŹĮæµÄĮņÕōĘųŗĶĮņ¹ĢĢå·Ö±šĶźČ«Č¼ÉÕ£¬ŗóÕ߷ųöČČĮæøü¶ą | |
| D£® | Čō2H2£Øg£©+O2£Øg£©=2H2O£Øg£©”÷H=-483.6 kJ•mol-1£¬ŌņH2Č¼ÉÕČČĪŖ241.8 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com