
(1)水的电离平衡曲线如图所示,若A点表示25 ℃时水的电离达平衡时的离子浓度,B点表示100 ℃时水的电离达平衡时的离子浓度。则100 ℃时1 mol·L-1的NaOH溶液中,由水电离出的c(H+)________ mol·L-1,KW(25℃)________KW(100 ℃)(填“>”、“<”或“=”)。25 ℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是________(填“促进”、“抑制”或“不影响”)。

(2)电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25 ℃) |
| HCN | K=4.9×10-10 mol·L-1 |
| CH3COOH | K=1.8×10-5 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1、 |
| K2=5.6×10-11 mol·L-1 |
①25 ℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为__________________________________________________________________。
②25 ℃时,等浓度的CH3COOH溶液和NaOH溶液等体积混合,所得溶液显碱性,则
c(Na+)________________________________________________________________________
c(CH3COO-)(填“>”、“<”或“=”)。
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为________________________________________________________________________。
解析 (1)100 ℃时,KW=10-12 mol2·L-2,1 mol·L-1的NaOH溶液中,c(H +)=1×10-12 mol
+)=1×10-12 mol ·L-1。25 ℃时,KW=10-14 mol2·L-2,KW(25 ℃)<KW(100 ℃)。NH4Cl溶液中,NH
·L-1。25 ℃时,KW=10-14 mol2·L-2,KW(25 ℃)<KW(100 ℃)。NH4Cl溶液中,NH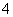 水解可促进水的电离。
水解可促进水的电离。
(2)①从电离平衡常数大小可知酸性:CH3COOH>HCN>HCO ,根据越弱越水解原理,可确定溶液的碱性:Na2CO3>NaCN>CH3COONa。②混合后的溶液中,电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为溶液显碱性,即c(H+)<c(OH-),所以c(Na+)>c(CH3COO-)。③根据酸性:H2CO3>HCN>HCO
,根据越弱越水解原理,可确定溶液的碱性:Na2CO3>NaCN>CH3COONa。②混合后的溶液中,电荷守恒式为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),因为溶液显碱性,即c(H+)<c(OH-),所以c(Na+)>c(CH3COO-)。③根据酸性:H2CO3>HCN>HCO ,则反应的化学方程式为NaCN+H2O+CO2===HCN+NaHCO3。
,则反应的化学方程式为NaCN+H2O+CO2===HCN+NaHCO3。
答案 (1)1×10-12 < 促进 (2)①Na2CO3>NaCN>CH3COONa ②>
③NaCN+H2O+CO2===HCN+NaHCO3


科目:高中化学 来源: 题型:
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②④
C.②③④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:pOH=-lg c(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH是
A.大于6.7 B.小于6.7
C.等于6.7 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中正确的是( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计的水银球插入蒸馏烧瓶溶液中
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com