
| V(标准)×c(标准) |
| V(待测) |
| V(标准)×c(标准) |
| V(待测) |


科目:高中化学 来源: 题型:
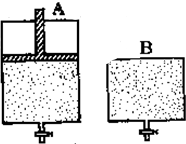 有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).
有两只密闭容器A和B.A容器有一个可以移动的活塞能使容器内保持恒压,B容器能保持恒容.起始时向这两个容器中分别充入等物质的量的体积比为2:1的SO2和O2的混合气体,并使A和B容积相等(如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铁粉加入到FeCl3溶液中:Fe+Fe3+=2Fe2+ |
| B、过量的氨水滴加到氯化铝溶液:Al3++4OH-═AlO2-+2H2O |
| C、氯气与水反应:Cl2+H2O═Cl-+2H++ClO- |
| D、硅酸钠溶液中通入过量CO2:SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
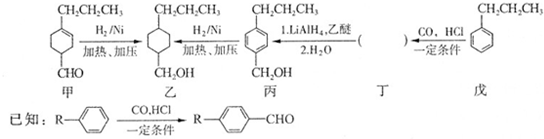
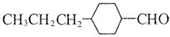 和
和查看答案和解析>>
科目:高中化学 来源: 题型:
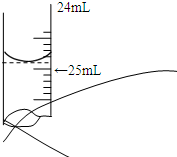 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol?L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol?L-1 HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 25.02 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 25.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
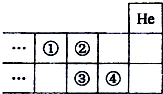
| A、①的气态氢化物比②的稳定 |
| B、②的最高价含氧酸的酸性比③强 |
| C、③的非金属性比④强 |
| D、④的原子半径比③小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.3% | B、12.5% |
| C、87.5% | D、无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com