
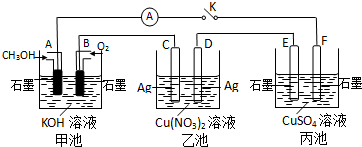
分析 由图可知甲图为原电池是一甲醇燃料电池,通甲醇的A为负极、B为正极,电解质溶液为KOH溶液,则A电极反应方程式为:2CH3OH+16OH--12e-═CO32-+12H2O,B电极反应式为:3O2+12e-+6H2O=12OH-;乙池为电解池,C为阳极电极反应为:Ag-e-=Ag+,D做阴极,电极反应为Cu2++2e-=Cu,乙池中C极质量减轻43.2,转移电子为0.4ol,故甲池消耗O2为0.1 mol体积为0.1 mol×22.4L/mol=2.24L=224mL;一段时间后,断开电键K,要使乙池恢复到反应前浓度需加入Cu;丙池中E为阳极,电极反应为:4OH--4e-=O2↑+2H2O,F电极为阴极,电极反应为:Cu2++2e-=Cu,故总反应方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑.
解答 解:(1)由图可知甲图为原电池是一甲醇燃料电池,通甲醇的A为负极、B为正极,电解质溶液为KOH溶液,则A电极反应方程式为:2CH3OH+16OH--12e-═CO32-+12H2O,B电极反应式为:3O2+12e-+6H2O=12OH-,
故答案为:原电池; CH3OH+8OH--6e-═CO32-+6H2O;
(2)丙池中E为阳极,电极反应为:4OH--4e-=O2↑+2H2O,F电极为阴极,电极反应为:Cu2++2e-=Cu,故总反应方程式为:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑,
故答案为:阴极;2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑;
(3)乙池为电解池,C为阳极电极反应为:Ag-e-=Ag+,D做阴极,电极反应为Cu2++2e-=Cu,乙池中C极质量减轻10.8g,则其物质的量n(Ag)=$\frac{10.8g}{108g/mol}$=0.1mol,则转移电子为0.1mol,故甲池消耗O2为0.1 mol×$\frac{1}{4}$=0.025mol,所以体积为0.025 mol×22.4L/mol=0.56L=560mL,
故答案为:560;
(4)一段时间后,断开电键K,要使丙池恢复到反应前浓度,根据2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2H2SO4+2Cu+O2↑可知,需加入CuO,CuO与硫酸生成硫酸铜和水,
故答案为:B.
点评 本题考查了原电池和电解池的相关知识,侧重于电极反应式书写和电子守恒在计算中应用的考查,题目难度中等,考查了学生对原电池和电解池原理的掌握情况.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成原电池时,铝作阴极极 | |
| B. | 形成原电池时,铜作负极 | |
| C. | 形成原电池时,电流由铝经导线流向铜 | |
| D. | 铝铆钉发生了电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 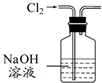 装置除去Cl2中含有的少量HCl | |
| B. | 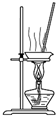 装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| C. | 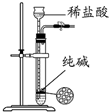 装置制取少量纯净的CO2气体 | |
| D. | 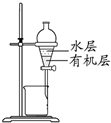 装置分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
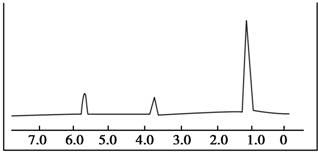
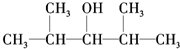 B.
B.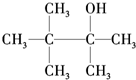 C.
C.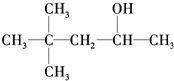
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
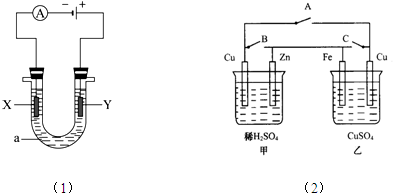
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入CH3COONa溶液 | B. | 改用3 mol•L-1盐酸 | ||
| C. | 用锌粉代替锌粒 | D. | 加入少量铜粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食物储存在冰箱里 | |
| B. | 向H2O2溶液中加入MnO2 | |
| C. | 用块状碳酸钙代替粉末状碳酸钙与稀盐酸反应 | |
| D. | 用0.1 mol/L H2SO4溶液代替1 mol/L H2SO4溶液与锌粒反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com