
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ/mol) | 348 | 413 | 436 | 358 | 1072 | 463 |
分析 (1)氢气的燃烧热是值1mol氢气完全燃烧生成液态水放出的热量,单位是kJ•mol-1;依据热化学方程式和盖斯定律计算得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式;
(2)根据反应热与反应物的物质的量成正比来解答;根据反应热应等于生成物与反应物的能量之差分析;
(3)依据化学反应的焓变=反应物总键能-生成物总键能.
解答 解:(1)2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1,即1mol氢气完全燃烧生成液态水放出的热量285.8 kJ,故氢气的燃烧热为△H=-285.8 kJ•mol-1,
①2H2(g)+O2(g)═2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H2=-36kJ•mol-1
依据盖斯定律①+②得到甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1,
故答案为:△H=-285.8 kJ•mol-1;CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1;
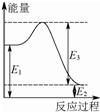
(2)由反应②和③△H的数值可知,当O2与H2O的物质的量之比为3:1时,反应②与③的总能量变化为0,O2的体积分数为x=0.75;由方程式②知36 kJ是该反应的能量变化,数值上与该反应的反应热相等,而反应热应等于生成物与反应物的能量之差,故36 kJ是E1、E2数值的差,
故答案为:0.75;C;
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)═CH3OH(g)中的焓变△H1=反应物总键能-生成物总键能,依据图表提供的化学键的键能计算得到
△H1=1072kJ•mol-1+2×436kJ•mol-1-(3×413kJ•mol-1+358kJ•mol-1+463kJ•mol-1)=-116 kJ•mol-1,
故答案为:-116 kJ•mol-1.
点评 本题主要考查了热化学方程式的意义,盖斯定律的运用,有关反应热的计算,难度不大,注意计算的准确性.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | CH3CH2OH+CH3COOH$→_{△}^{浓硫酸}$CH3COOHCH2CH3+H2O | |
| B. | 2CH3CH2OH$→_{140℃}^{浓硫酸}$CH3CH2OCH2CH3+H2O | |
| C. | CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O | |
| D. | CH3CH2OH+HBr→CH3CH2Br+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为8的氮原子:8N | |
| B. | 次氯酸的电子式: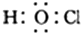 | |
| C. | PCl5分子的每个原子都满足8电子稳定结构 | |
| D. | 用电子式表示NaCl的形成过程: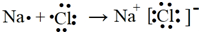 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | D元素处于元素周期表中第三周期ⅣA族 | |
| B. | 四种元素的原子半径:A<B<D<C | |
| C. | B、D的氧化物均为酸性氧化物 | |
| D. | 一定条件下,B单质能置换出D单质,C单质能置换出A单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 第2周期 | ⑥ | ⑦ | ||||||
| 第3周期 | ① | ③ | ⑤ | ⑧ | ⑨ | ⑩ | ||
| 第4周期 | ② | ④ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O与D2O互称同素异形体 | |
| B. | 1H与D互称同位素 | |
| C. | 氘(D)原子核外有1个电子 | |
| D. | 1H218O与D216O的相对分子质量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有⑤ | B. | ⑤⑥ | C. | ①④⑧ | D. | ②③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定是x+2 | B. | 肯定是x+2或x+8或x+32 | ||
| C. | 肯定是x+2或x+12或x+26 | D. | 肯定是x+2或x+10或x+26 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com