
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 2L0.5mol/L亚硫酸溶液中含有的H+个数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |
分析 A.一个D2O和H2O分子中质子数都是10,18g的D2O物质的量=$\frac{18g}{20g/mol}$=0.9mol、18gH2O的物质的量=$\frac{18g}{18g/mol}$=1mol,根据N=nNA知,其分子数之比等于物质的量之比=0.9mol:1mol=0.9:1,结合分子构成计算质子数;
B.n(H2SO3)=0.5mol/L×2L=1mol,亚硫酸是弱电解质,在水溶液中部分电离,且第二步电离程度远远小于第一步电离程度;
C.过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,每生成1mol氧气转移电子物质的量=1mol×2×[0-(-1)]=2mol,据此计算生成0.1mol氧气转移的电子数;
C.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4.
解答 解:A.一个D2O和H2O分子中质子数都是10,18g的D2O物质的量=$\frac{18g}{20g/mol}$=0.9mol、18gH2O的物质的量=$\frac{18g}{18g/mol}$=1mol,根据N=nNA知,其分子数之比等于物质的量之比=0.9mol:1mol=0.9:1,二者的分子数分别是0.9NA、NA,结合分子构成知,二者的质子数分别是9NA、10NA,故A错误;
B.n(H2SO3)=0.5mol/L×2L=1mol,亚硫酸是弱电解质,在水溶液中部分电离,且第二步电离程度远远小于第一步电离程度,所以溶液中含有的H+个数远远小于2NA,故B错误;
C.过氧化钠和水反应方程式为2Na2O2+2H2O=4NaOH+O2↑,Na2O2中O元素的化合价为-1价,每生成1mol氧气转移电子物质的量=1mol×2×[0-(-1)]=2mol,则生成0.1mol氧气转移的电子0.2mol,电子数为0.2NA,故C正确;
D.NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2?N2O4,所以产物分子数小于2NA,故D错误;
故选C.
点评 本题考查阿伏伽德罗常数有关计算,涉及氧化还原反应、可逆反应、弱电解质的电离、同位素等知识点,明确物质的性质、物质结构、物质之间的转化即可解答,易错选项是AD,注意A中D2O的相对分子质量是20,注意D中存在转化关系2NO2?N2O4.


科目:高中化学 来源: 题型:选择题
| A. | 配离子只能存在于晶体中 | |
| B. | 配位体只能是多原子分子 | |
| C. | 配合物的稳定性是指配合物在受热情况下是否易分解 | |
| D. | 血红素中的Fe2+与CO形成的配合物比与O2形成的配合物稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
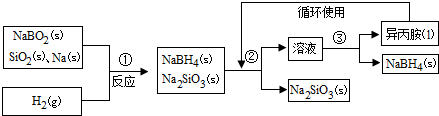
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60gSiO2晶体中含有2NA个Si-O键 | |
| B. | 18D2O(重水)完全电解,转移2NA个电子 | |
| C. | 1Llmol•L-1 Na2CO3溶液中CO32-数为NA | |
| D. | 16g甲烷含有σ数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
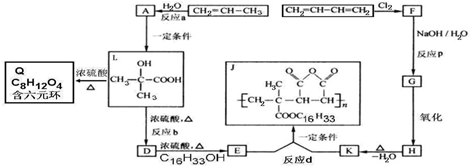
 .
. ;L→Q
;L→Q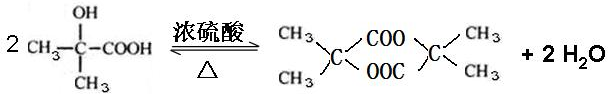 .
.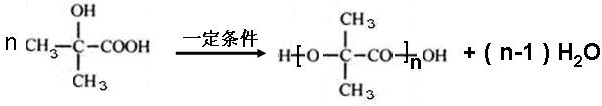 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com