
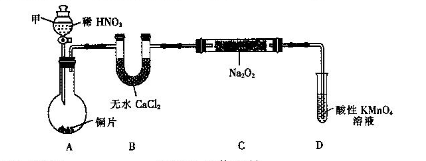
 ,发生反应的离子方程式为_____________。
,发生反应的离子方程式为_____________。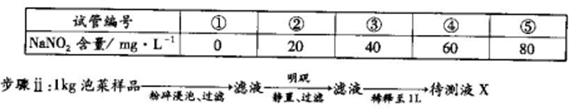




科目:高中化学 来源:不详 题型:单选题
| A.可用25 mL碱式滴定管量取20.00 mL KMnO4溶液 |
| B.用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 |
| C.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的2/3,液体也不能蒸干 |
| D.为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.分液时的分液漏斗的下端与过滤时漏斗的下端均要贴紧烧杯内壁,其原因相同 |
| B.配制一定物质的量浓度溶液时,在溶解、移液、洗涤、定容时均要用到玻璃棒 |
| C.浓硫酸和浓氢氧化钠溶液溅到皮肤上,均应马上用大量的水冲洗,以防腐蚀皮肤 |
| D.不用其它试剂,只用胶头滴管和试管即可鉴别出NaHCO3、Ba(OH)2、稀H2SO4三种溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 现象或原理 |
| A | 取少量KI溶液,先滴加氯水,再加入少量苯,振荡、静置 | 溶液分层,下层呈紫红色 |
| B | 将稀盐酸或氢氧化钠溶液慢慢滴入氢氧化铝胶体中 | 均先沉淀后溶解 |
| C | 将浓硝酸加入盛有铂、金的烧杯中,不反应,加入一定量浓盐酸后,铂、金溶解 | 浓盐酸氧化性强于浓硝酸 |
| D | 将40.0 g NaOH固体溶于1.0 L蒸馏水中配成溶液 | 溶液物质的量浓度为1.0mol﹒L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
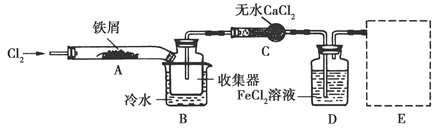
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

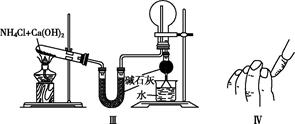
| A.实验Ⅰ:制取并收集氢气 |
| B.实验Ⅱ:验证葡萄糖的还原性 |
| C.实验Ⅲ:实验室制氨气并收集干燥的氨气 |
| D.实验Ⅳ:检查碱式滴定管是否漏液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴苯中混有溴:加入碘化钾溶液后分液 |
| B.除去SO2中的少量CO2:通过盛有饱和Na2CO3溶液的洗气瓶 |
| C.用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤 |
| D.中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com