
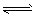 HOCH2CH2NH3++OH-;
HOCH2CH2NH3++OH-; 
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������� |
| ���� |
| �� |
| ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� |
| Ͷ�ϱ�[n��H2��/n��CO2��] | 500K | 600K | 700K | 800K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ��ͨ��ͨ��������4�²�©��ȱר���⻯ѧ�Ծ��������棩 ���ͣ������
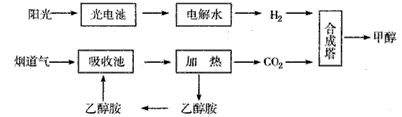
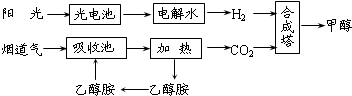
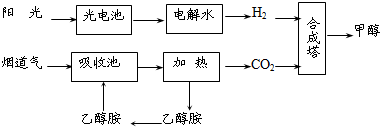
��14�֣�����һ�������£���ѧ�����ô��̵����з����CO2��̫���ܵ�ص��ˮ������H2�ϳɼ״������������ͼ��ʾ���Իش��������⣺

(1)�úϳ�·�߶��ڻ��������ļ�ֵ���� ��
(2)15��20%���Ҵ�����HOCH2CH2NH2��ˮ��Һ���������ԣ������ϳ���·������CO2���ռ��������ӷ���ʽ��ʾ�Ҵ���ˮ��Һ�������Ե�ԭ�� ��
(3)CH3OH��H2��ȼ���ȷֱ�Ϊ����H����725.5kJ/mol����H����285.8kJ/mol��д����ҵ����CO2��H2�ϳ�CH3OH���Ȼ�ѧ����ʽ�� ��
��ȼú�����е�CO2ת��Ϊ���ѵķ�Ӧԭ��Ϊ��
2CO2(g) + 6H2(g) CH3OCH3(g)
+ 3H2O(g)
CH3OCH3(g)
+ 3H2O(g)
��֪һ��ѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ��CO2��ת���ʼ��±���
|
Ͷ�ϱ�[n(H2) / n(CO2)] |
500 K |
600 K |
700 K |
800 K |
|
1.5 |
45% |
33% |
20% |
12% |
|
2.0 |
60% |
43% |
28% |
15% |
|
3.0 |
83% |
62% |
37% |
22% |
(4)�÷�Ӧ���ʱ���H 0���ر���S___0�����������
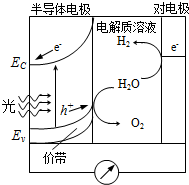
(5)�ü�����Ϊȼ�ϵ��ԭ�ϣ��ڼ��Խ����иõ�ظ����ĵ缫��Ӧʽ ������1.12 L��min-1����״������������õ����ͨ����ѣ��е�Ϊ-24.9 �棩���øõ�ص��500 mL 2 mol��L-1 CuSO4��Һ��ͨ��0.50 min�������Ͽ���������ͭ g��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com