
| A. | 增大反应物浓度,可增大单位体积内活化分子数,从而使有效碰撞次数增多 | |
| B. | 有气体参加的化学反应,增大压强(缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 升高温度能使化学反应速率增大的主要原因是增加了反应物分子中活化分子的百分数 | |
| D. | 催化剂能增大单位体积内活化分子的百分数,从而成千上万倍地增大化学反应速率 |
分析 增大浓度、增大压强,均使活化分子数目增多;而升高温度、使用催化剂,均使活化分子百分数增多,以此来解答.
解答 解:A.增大浓度,单位体积活化分子数目增多,则使有效碰撞次数增大,反应速率加快,故A正确;
B.有气体参加的反应,增大压强,单位体积活化分子数目增多,从而使反应速率增大,但活化分子百分数不变,故B错误;
C.升高温度,提供分子需要的能量,活化分子的百分数增大,从而使有效碰撞次数增大,则反应速率加快,故C正确;
D.催化剂,降低反应所需的活化能,增大单位体积内活化分子的百分数,故D正确.
故选B.
点评 本题考查影响反应速率的因素,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中加入HCl酸化后,再加入BaCl2溶液,有白色沉淀产生,则溶液中含有SO42- | |
| B. | 溶液中加入KSCN溶液,无红色出现,继续加入氯水,溶液变红,说明溶液中一定含有Fe2+ | |
| C. | 溶液中加入NaOH溶液,加热后产生使湿润的红色石蕊试纸变蓝的气体,则可推测该溶液中含有NH4+ | |
| D. | 向溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测溶液中含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
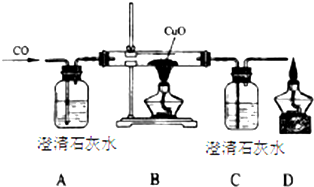 甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.
甲同学设计了如下实验装置验证一氧化碳的部分性质并验证产物.实验时,在点燃B处酒精灯之前先通入一氧化碳排出装置中的空气,然后继续实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物熔沸点较高、共价化合物熔沸点较低 | |
| B. | 非金属原子间不可能形成离子化合物 | |
| C. | 确定某化合物为离子化合物,可以用融化时能否导电来判断 | |
| D. | 共价化合物中可能有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
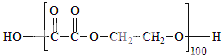 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.
无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用.| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% | 11.44% | 13.56% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com