
【题目】现有金属单质A、B、C和气体甲、乙、丙及物质D、E、F、G、H,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
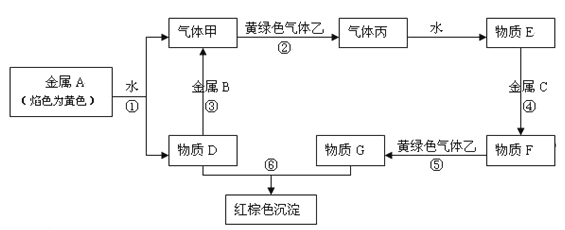
请根据以上信息回答下列问题:
(1)写出金属元素A的原子结构示意图:_______________。
(2)写出下列反应的离子方程式:
反应③___________;反应⑤____________________
(3)检验物质G中阳离子的操作方法_____________________。
(4)实验室制取黄绿色气体乙的化学方程式为__________________,在该反应中如有0.5 mol乙生成,转移的电子的物质的量是_____mol。制取完毕,多余的乙将用D的水溶液来吸收,其离子方程式为____________________。
【答案】 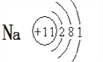 2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- 取物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明物质G中有Fe3+离子。 MnO2+4HCl(浓)
2Al+2OH-+2H2O=2AlO2-+3H2↑ 2Fe2++Cl2=2Fe3++2Cl- 取物质G少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明物质G中有Fe3+离子。 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 1 Cl2+2OH =Cl+ClO+H2O
MnCl2+Cl2↑+2H2O 1 Cl2+2OH =Cl+ClO+H2O
【解析】金属A焰色反应为黄色,故A为金属Na,由反应①可知,D为NaOH,气体甲为H2;氢氧化钠与金属B反应生成氢气,故金属B为Al.黄绿色气体乙为Cl2,与氢气反应生成丙为HCl,HCl溶于水得物质E为盐酸.氢氧化钠与物质G反应生成红褐色沉淀是Fe(OH)3,故物质G中含有Fe3+,E与金属C反应生成F,F与氯气反应生成G,可推知C为Fe,F为FeCl2,G为FeCl3,
(1)金属元素Na的核电荷数11,其原子结构示意图为![]() ;
;
(2)反应③是金属Al溶解于NaOH溶液生成氢气,发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;反应⑤是在氯化亚铁溶液中通氯气,将Fe2+氧化为Fe3+,发生反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-;
(3)检验FeCl3溶液中Fe3+的方法是取FeCl3少许于试管中,向其中滴加少量的KSCN溶液,溶液变为血红色(或红色),证明FeCl3中有Fe3+离子;
(4)实验室用二氧化锰和浓盐酸混合加热制取氯气,发生反应的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O,在该反应中如有0.5 mol氯气生成,转移的电子的物质的量是1mol。制取完毕,多余的Cl2对环境有污染,需用NaOH的水溶液来吸收,其离子方程式为 Cl2+2OH =Cl+ClO+H2O。
MnCl2+Cl2↑+2H2O,在该反应中如有0.5 mol氯气生成,转移的电子的物质的量是1mol。制取完毕,多余的Cl2对环境有污染,需用NaOH的水溶液来吸收,其离子方程式为 Cl2+2OH =Cl+ClO+H2O。


科目:高中化学 来源: 题型:
【题目】“低碳生活”是指减少能源消耗、节约资源,从而减少二氧化碳排放的生活方式。下列不符合“低碳生活”的做法是
A.节能灯代替白炽灯 B.太阳能热水器代替燃气热水器
C.纸巾代替棉手帕 D.环保袋代替一次性塑料袋
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知常温下,Ksp[Fe(OH)3]=4.0×10-38, 在FeCl3溶液中加入NaHCO3溶液产生沉淀和气体,反应的离子方程式为:____________;若将所得悬浊液的pH调整为4,则溶液中Fe3+浓度为_________molL-1
(2)常温下,浓度均为0.1molL-1的下列五种钠盐溶液的PH如下表
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是__________。根据表中数据,浓度均为0.01 molL-1的下列四种酸的溶液分别稀释100倍,PH变化最大的是___________(填编号)。
A.HCN B.HClO C.CH3COOH D.H2CO3
(3) 下列说法不正确的是___ ___ ___ (填序号)
A.某温度下纯水中的c(H+)=10-6,故显酸性
B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
C.相同温度下,0.1mol/LNH4Cl溶液中NH4+的浓度比0.1mol/L氨水中NH4+的浓度大
D.相同温度下,PH均为8的Na2CO3和NaHCO3溶液,前者物质的量浓度大
E.向饱和石灰水中加入CaO固体,溶液中Ca2+、OH-的物质的量均减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示的装置在实验室中用途比较广泛:

①排空气法收集气体,若收集CO2气体,进气口为_______ (填“a”或“b”)。
②若瓶中装满水,可用于收集下列气体中的_________(选填编号)。
A、NO B、NO2 C、NH3 D、HCl
此时进气口为____________(填“a”或“b”)。
③如果广口瓶中盛放浓硫酸,可用作气体干燥装置,则该装置不可以干燥的气体有____________(选填编号)。
A、HCl B、NH3 C、H2 D、CO
④此装置还可用于除去气体中的杂质气体。若要用此装置除去CO2中混有的少量SO2气体,则装置中应盛放的液体可能是____________(选填编号)。
A、NaOH溶液 B、饱和Na2CO3溶液 C、饱和NaHCO3溶液 D、浓H2SO4
(2)下面是中学化学实验中常见的几种仪器:
A.量筒 B.容量瓶 C.试管 D.圆底烧瓶 E.托盘天平
①其中仪器上要标出使用温度的是_____________(填选项)
②可用作反应容器并能进行加热的是___________(填选项)
③下列操作,使得实验结果偏小的是____________(填选项)
A.称取5.2 gNaCl固体时,将砝码放在左盘,NaCl固体放在右盘
B.配制一定物质的量浓度的NaCl溶液,转移NaCl溶液前,容量瓶中已有少许蒸馏水
C. 配制一定物质的量浓度的NaCl溶液,定容时俯视读数。
D.用量筒量取一定体积的浓硫酸,浓硫酸倒入烧杯后,用蒸馏水继续冲洗量筒内壁并将洗涤液倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法错误的是
A. 使用含有氯化钙的融雪剂会加快桥梁的腐蚀
B. 纳米铁粉通过物理吸附可除去污水中的Pt2+、Cu2+、Cd2+、Hg2+等
C. 用合成聚碳酸酯可降解塑料,实现碳的循环利用
D. 近期在北方出现的雾霾是一种分散系,戴活性炭口罩的原理是吸附作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将小块生石灰投入盛有水的试管中,发生剧烈反应。一段时间后,用手触摸试管外壁感觉烫手,这个实验事实说明该反应
A. 是放热反应 B. 是吸热反应
C. 反应过程中热能转化为化学能 D. 反应物的总能量等于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4,4FeO42-+10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-)是一种新型的自来水处理剂,它的性质和作用是( )
A.有强氧化性,可消毒杀菌,还原产物能吸附水中杂质
B.有强还原性,可消毒杀菌,氧化产物能吸附水中杂质
C.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
D.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛对人体体液无毒且有惰性,能与肌肉和骨骼生成在一起,故有“生命金属”之称。下列有关4822Ti和5022Ti的说法正确的是
A. 质量数相同,互为同位素
B. 质子数相同,互为同位素
C. 中子数相同,属同一种元素的不同核素
D. 核外电子数相同,中子数不同,不能互称为同位素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com