
 Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
Na2S2O3,常温下溶液中析出晶体为Na2S2O3?5H2O。Na2S2O3·5H2O于40~45℃熔化,48℃分解;Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如右图所示。
| A.BaCl2溶液 | B.浓H2SO4 | C.酸性KMnO4溶液 | D.NaOH溶液 |

 Na2S2O3
Na2S2O3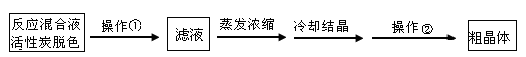
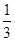 ×0.5880g÷294g/mol c×0.02000L
×0.5880g÷294g/mol c×0.02000L

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在中和热测定的实验中,将氢氧化钠和盐酸混合反应后的最高温度作为末温度 |
| B.纸层析法分离Fe3+和Cu2+ 的实验中,点样后的滤纸无需晾干就可将其浸入展开剂中 |
| C.将KNO3和NaCl的混合液加热并浓缩至有晶体析出时,趁热过滤可分离得NaCl晶体 |
| D.当锌完全溶解后,铁与酸反应产生氢气的速率会显著减慢,借此可判断锌镀层是否反应完全 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向两份蛋白质溶液中分别滴加NaCl溶液和 CuSO4溶液。均有固体析出 | 蛋白质均发生了变性 |
| B | 取少量Fe(NO3)2试样加水溶解,加稀硫酸酸化, 滴‘加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经 变质 |
| C | 将少量某物质的溶液滴加到新制的银氨溶液中, 水浴加热后有银镜生成 | 该物质一定属于醛类 |
| D | 同条件下,分别将0.1mol·L-1的盐酸和醋酸进 行导电性实验,与醋酸串联的灯泡较暗 | 醋酸是弱酸 |
查看答案和解析>>
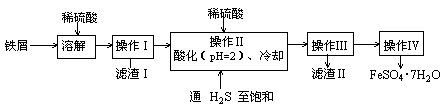
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.利用图①装置做喷泉实验 |
| B.利用图②装置吸收尾气SO2 |
| C.利用图③装置进行胶体电泳实验可以说明Fe(OH)3胶体带正电荷 |
| D.利用图④装置用MnO2和浓盐酸制备并收集Cl2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | A | B | C | D |
| 实验 | 用CCl4提取碘水中的I2 | 分离乙醇中的I2 | 加热分解 MgCl2?6H2O得到 纯净的MgCl2 | 配制100mL 0.1000mol/L K2Cr2O7溶液 |
| 装置或仪器 |  | 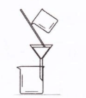 | 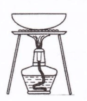 | 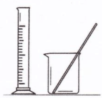 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用蒸馏水润湿的pH试纸所测定的某酸溶液的pH |
| B.用容量瓶配制溶液,定容后摇匀液面下降,再加蒸馏水至刻度线所配制的溶液浓度 |
| C.用仰视量筒刻度量取的一定量浓硫酸所配制的0.1mol·L-1H2SO4溶液的浓度 |
| D.用待测液润洗的锥形瓶进行中和滴定所测定的待测液浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.过滤时,用玻璃棒引流 |
| B.蒸馏过程中,冷却水上口进,下口出 |
| C.实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 |
| D.稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢地倒入水中,并用玻璃棒不断搅拌 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com