
����Ŀ��ij100mL��Һ���ܺ��� Na+��NH4+��Fe3+��CO32����SO42����Cl���е������֣�ȡ����Һ��������ʵ�飬ʵ�������ͼ���������Լ�������������ȫ���ݳ�������˵����ȷ����
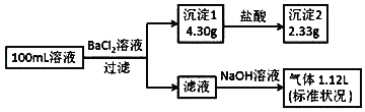
A. ��ԭ��Һ�в����� Na+���� c��Cl������0.1molL��1
B. ԭ��Һ���ܴ��� Cl�� �� Na+
C. ԭ��Һ�� c��CO32������ 0.01molL��1
D. ԭ��Һһ������ CO32����SO42����һ�������� Fe3+
���𰸡�D
��������
����BaCl2��Һ֮���г������ɣ��Ҽ����������֮�����������٣���˵��һ����CO32����SO42�����������ӣ�һ��û��Fe3+��Fe3+��CO32���ᷢ��˫ˮ�ⷴӦ�����ܹ��棩���ҳ���2ΪBaSO4��n(BaSO4)=![]() ��m(BaCO3)=4.30g-2.33g=1.97g����n(BaCO3)=
��m(BaCO3)=4.30g-2.33g=1.97g����n(BaCO3)= ![]() ������NaOH��Һ����1.12L����������壬����Һ����NH4+��NH3��0.05mol����n(NH4+)=0.05mol��CO32����SO42�������ĸ���ɵ����ʵ���Ϊ0.01mol��2��0.01mol��2=0.04mol��NH4����������ɵ����ʵ���Ϊ0.05mol��1=0.05mol�����ݵ���غ㣬�����ƶϳ���Һ��һ����Cl-��������Ϊ0.01mol����Ϊ���ж��Ƿ���Na+�������Na+����Ҫ���ڵ�Cl-ȥ������Һ�ĵ����ԣ���
������NaOH��Һ����1.12L����������壬����Һ����NH4+��NH3��0.05mol����n(NH4+)=0.05mol��CO32����SO42�������ĸ���ɵ����ʵ���Ϊ0.01mol��2��0.01mol��2=0.04mol��NH4����������ɵ����ʵ���Ϊ0.05mol��1=0.05mol�����ݵ���غ㣬�����ƶϳ���Һ��һ����Cl-��������Ϊ0.01mol����Ϊ���ж��Ƿ���Na+�������Na+����Ҫ���ڵ�Cl-ȥ������Һ�ĵ����ԣ���
A. ��ԭ��Һ�в����� Na+���� c(Cl��)= ![]() ��A����
��A����
B. ԭ��Һ��һ����Cl-��������Na+��B����
C. �����㣬ԭ��Һ�У�n(CO32-)=0.01mol����c(CO32-)=0.01mol��0.1L=0.1mol L��1��C����
D. ����BaCl2��Һ֮���г������ɣ��Ҽ����������֮�����������٣���˵��һ����CO32����SO42�����������ӣ�һ��û��Fe3+��D��ȷ��
�ʺ���ѡ��ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ش��������⣺
��1����̬Siԭ���У�����ռ�ݵ�����ܲ����Ϊ___�����ܲ���е�ԭ�ӹ����Ϊ___��
��2��BF3��һ������ˮ�γ�(H2O)2BF3����Q��Q��һ�������¿�ת��ΪR��

����Q����������������______(�����)��
a�����Ӽ� b�����ۼ� c����λ�� d�����
��3����һ������I1��Zn��___I1��Cu)(��������������С����)��ԭ����______��
��4��Ti�����ԭ�Ӷѻ���ʽΪ�����ѻ�(��ͼ��ʾ)��������Tiԭ�ӵ���λ����___��ijTi�����Ļ�ѧʽ��[Ti (H2O)5Cl]Cl2��H2O��1 mol��������к���λ������Ŀ��___��
![]()
��5��ʯīϩ����ͼa����һ���ɵ���̼ԭ�ӹ��ɵ�ƽ��ṹ����̼���ϣ�ʯīϩ�в���̼ԭ�ӱ���������ƽ��ṹ�ᷢ���ı䣬ת��Ϊ����ʯīϩ����ͼb����
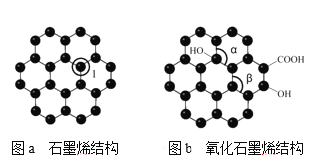
ͼa�У�1��C������C�γ������ĸ���Ϊ____��ͼb�м�����___��������������>������<���������� ��������ͼb��ʾ������ʯīϩ��ɢ��H2O�У�������ʯīϩ�п���H2O�γ������ԭ����_____����Ԫ�ط��ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�������Ƹ﹤ҵ������CrԪ�صĻ����������ù�������(�����ȡҺ�н���������Ҫ��Cr3���������Fe3����Fe2����Al3����Ca2����Mg2��)��
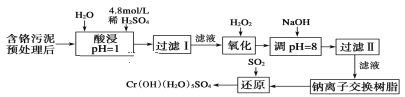
�����²���������������������ʽ����ʱ��Һ��pH������
������ | Fe3�� | Fe2�� | Mg2�� | Al3�� | Cu2�� | Cr3�� |
��ʼ����ʱ��pH | 1.9 | 7.0 | �� | �� | 4.7 | �� |
������ȫʱ��pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(��9�ܽ�) |
��1�����ʱ��Ϊ����߽�ȡ�ʿɲ�ȡ�Ĵ�ʩ��___(дһ������)��
��2����pH��8��Ϊ�˳�ȥ___(��Fe3����Al3����Ca2����Mg2��)��
��3������ƽ������ԭ��Ӧ����ʽ��_Na2Cr2O7��_SO2��_H2O=________Cr(OH)(H2O)5SO4��_Na2SO4��ÿ����1molCr(OH)(H2O)5SO4����SO2�����ʵ���Ϊ___��
��4��ӡˢ��·ͭ�帯ʴ������FeCl3����ʴͭ���Ļ����Һ�У���Cu2����Fe3����Fe2����Ũ�Ⱦ�Ϊ0.10mol/L��������ϱ����������ݺ��ṩ��ҩƷ��������ȥCuCl2��Һ��Fe3�� ��Fe2����ʵ�鲽�裺��___����___���۹��ˡ�(�ṩ��ҩƷ��Cl2��ŨH2SO4��NaOH��Һ��CuO��Cu)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ṩ��һ�����ʻش����⣺
��NH4Cl ��MgCl2 ��H2S ��Na2O2 ��MgO ��Cl2 ��NaOH
��1�������й��ۼ�����_________���������Ӽ����й��ۼ�����_________(����ű�ʾ��
��2�����ӻ�������_____________________��������ű�ʾ��
��3��Na2O2 �ĵ���ʽ_____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
G��һ�����������м��壬ij�ֺϳ�·�����£�
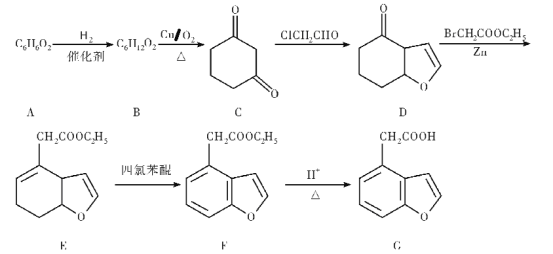
��������ת����ϵ���ش��������⣺
��1�������廯����A��������___________��
��2��F�к��������ŵ�������___________��
��3��B��C�ķ�Ӧ����Ϊ_______________��
��4��F��G�ķ�Ӧ����ʽΪ___________________________��
��5��G��ͬ���칹����ͬʱ�������������Ĺ���__________________�֣����������칹����
�ٷ����廯������ܷ���������Ӧ����ֻ��һ�ֹ����ţ��ۺ˴Ź���������ʾΪ4��壬�ҷ������Ϊ1��2��2��3����д����������һ�ֵĽṹ��ʽ_______________________��
��6�����������ϳ�·�ߣ�д����![]() ��BrCH2COOC2H5Ϊԭ�ϣ����Լ���ѡ�����Ʊ�
��BrCH2COOC2H5Ϊԭ�ϣ����Լ���ѡ�����Ʊ�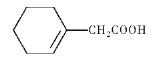 �ĺϳ�·��____________��
�ĺϳ�·��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ԡ����ʵ�����Ϊ���ĵļ����ǻ�ѧ����Ļ����������롰���ʵ�������صļ�����ȷ����(����)
A. ����CO��CO2��O3�������壬���Ƿֱ���1 mol O����������������ʵ���֮��Ϊ3��2��1
B. 28 g CO��22.4 L CO2�к��е�̼ԭ����һ�����
C. ��״���£�11.2 L X������ӵ�����Ϊ16 g����X�����Ħ��������32
D. a g Cl2����b����ԭ�ӣ����ӵ�����NA����ֵ�ɱ�ʾΪ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��17.4g MnO2��240 mL 10 mol/L(�ܶ�Ϊ1.10g/mL)������(����)��ϼ���(����������ӷ�)��ʹ���ַ�Ӧ��������Һ�м���������AgNO3��Һ������֪��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
����(1)10 mol/L���������������____________
(2)�����������ڱ�״���µ����______________��
(3)��������������_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ע�����м�������Na2SO3���壬����������Ũ���ᣨ�Բ��Ӵ�ֽ��Ϊ�����������й�˵����ȷ���ǣ�������
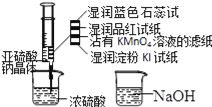
A. ʪ����۵⻯����ֽδ����˵����Ԫ�صķǽ�����ǿ�ڵ�Ԫ��
B. մ��KMnO4��Һ����ֽ��ɫ֤����SO2����Ư����
C. ʵ��ɰ�ע�����е����ʻ�������NaOH��Һ�У��Լ��ٻ�����Ⱦ
D. ��ɫʯ����ֽ���˵��SO2������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У�����ת�Ʒ�����ͬ�����ʵ�ͬ��Ԫ��֮����ǣ� ��
A. 2H2S��SO2��3S��2H2OB. 2KMnO4![]() K2MnO4��MnO2��O2��
K2MnO4��MnO2��O2��
C. 2KClO3![]() 2KCl��3O2��D. Cu2O��H2SO4=CuSO4��Cu��H2O
2KCl��3O2��D. Cu2O��H2SO4=CuSO4��Cu��H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com