


科目:高中化学 来源: 题型:
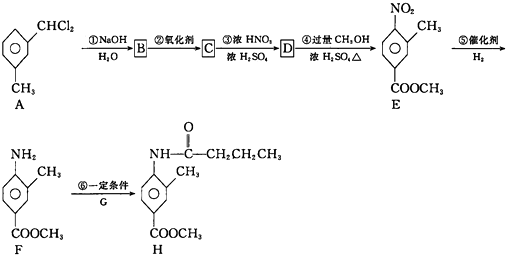
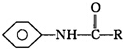
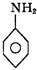 +
+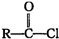
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液体呈无色 |
| B、液体分两层,上层为紫色,下层接近无色 |
| C、液体呈紫红色 |
| D、液体分两层,上层接近无色,下层为紫色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯硝化,苯酚和溴水反应,皂化反应,乙烯与溴水反应 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阴极生成的铜为5.6g |
| B、上述电解过程中共转移0.2 mol电子 |
| C、电解得到的Cu的物质的量为0.5mol |
| D、电解后溶液呈碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(Fe)=0.5 mol?L-1?min-1 |
| B、v(H2SO4)=1 mol?L-1?min-1 |
| C、v(H2)=1 mol?L-1?min-1 |
| D、v(FeSO4)=0.5 mol?L-1?min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10.00ml |
| B、15.00ml |
| C、大于15.00ml |
| D、小于15.00ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、升高温度,Kw增加,pH增大 |
| B、向水中加入少量NaOH固体,平衡向逆方向移动,c(OH-)增大 |
| C、向水中加入少量CH3COONa固体,平衡向正方向移动,c(H+)增大 |
| D、25℃时,纯水中c(H+)>10-7mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com