
分析 (1)将54.4g铁和氧化铁的混合粉末投入足量的稀硫酸中全部溶解,收集到标况下4.48L H2,当向溶液中滴几滴KSCN溶液时,溶液不显红色,说明最终得到硫酸亚铁,发生反应为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,根据铁和稀硫酸反应方程式可知生成氢气消耗铁的物质的量,设铁的物质的量为x,氧化铁的物质的量为y,根据转移电子守恒及二者质量列方程计算原混合物中Fe和Fe2O3的质量;
(2)反应后溶液中的溶质为硫酸亚铁,根据Fe元素守恒可知硫酸亚铁的物质的量,然后根据c=$\frac{n}{V}$计算出生成的溶质的物质的量浓度.
解答 解:(1)将54.4g铁和氧化铁的混合粉末投入足量的稀硫酸中全部溶解,收集到标况下4.48L H2,当向溶液中滴几滴KSCN溶液时,溶液不显红色,说明最终得到硫酸亚铁,发生反应为Fe+2H+=Fe2++H2↑、Fe2O3+6H+=2Fe3++3H2O、Fe+2Fe3+=3Fe2+,
生成氢气的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,根据反应Fe+2H+=Fe2++H2↑可知生成0.2mol氢气消耗Fe的物质的量为0.2mol,
设铁的物质的量为x,氧化铁的物质的量为y,
根据原混合物总质量可得:①56x+160y=54.4g,根据电子守恒可得:②2(x-0.2)=2y(3-2),
联立①②解得:x=0.4mol、y=0.2mol,
原混合物中Fe和Fe2O3的质量分别为:m(Fe)=56g/mol×0.4mol=22.4g,m(Fe2O3)=160g/mol×0.2mol=32g,
答:原混合物中Fe和Fe2O3的质量分别为22.4g、32g;
(2)反应后最终得到的为硫酸亚铁溶液,根据Fe元素守恒可知硫酸亚铁的物质的量为:0.4mol+0.2mol×2=0.8mol,
所以生成的溶质的物质的量浓度为:c=$\frac{0.8mol}{0.2L}$=4mol/L,
答:生成的溶质的物质的量浓度为4mol/L.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意根据守恒思想进行计算,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.
如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
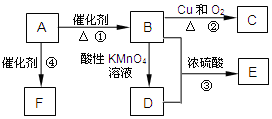 有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.
有机物A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平.C在一定条件下也会生成D,D能使石蕊溶液变红;E是具有果香味的有机物,F是一种高分子化合物,可制成多种包装材料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下A、B两气体的密度之比为a:b | |
| B. | 同质量气体A与B的分子数之比为b:a | |
| C. | 两种气体A与B的相对分子质量之比为b:a | |
| D. | 相同状况下同体积A、B质量之比为a:b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时水的转化率为71.4% | |
| B. | 此时CO2的体积分数为20.4% | |
| C. | 若再向容器内通入5mol H2O,则达到新平衡时,H2O的转化率升高 | |
| D. | 若从容器内移走5mol H2O,则达到新平衡时,CO的转化率升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2 min的平均速率v(Z)=2.0×10-3mol•L-1•min-1 | |
| B. | 其他条件不变,降低温度,正反应速率增大、逆反应速率减小 | |
| C. | 该温度下此反应的平衡常数K=1.44 | |
| D. | 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.
煤的气化在煤化工中占有重要地位,至今仍然是化学工业的重要组成部分.| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com