
| A. | 电解水若生成33.6L(标准状况)气体时电路中通过的电子数目为2NA | |
| B. | 5NH4NO3=2HNO3+4N2↑+9H2O反应中,生成56gN2时,转移电子数目为7.5NA | |
| C. | 用2mL5mol/L的FeCl3溶液制成的氢氧化铁胶体中所含胶粒数为0.01NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
分析 A.标况下33.6L气体的物质的量为1.5mol,电解过程中阳极生成氧气、阴极生成氢气,氧气和氢气的物质的量之比为1:2,据此计算出生成氧气的物质的量,再计算出转移的电子数;
B.该反应中电子转移情况为: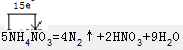 ,根据n=$\frac{m}{M}$计算出氮气的物质的量,再计算出转移的电子数;
,根据n=$\frac{m}{M}$计算出氮气的物质的量,再计算出转移的电子数;
C.氢氧化铁胶粒为氢氧化铁的聚集体;
D.铁与浓硫酸发生钝化,阻止了反应的继续进行.
解答 解:A.电解水若生成33.6L(标准状况)气体,标况下该气体的物质的量为:$\frac{33.6L}{22.4L/mol}$=1.5mol,电解中生成氢气和氧气的物质的量之比为2:1,则生成氧气的物质的量为:1.5mol×$\frac{1}{3}$=0.5mol,转移电子为:0.5mol×4=2mol,电路中通过的电子数目为2NA,故A正确;
B.5NH4NO3=2HNO3+4N2↑+9H2O反应中,电子转移情况为: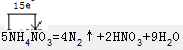 ,58g氮气的物质的量为:$\frac{56g}{28g/mol}$=2mol,生成2mol氮气转移电子的物质的量为:15mol×$\frac{2}{4}$=7.5mol,转移电子数目为7.5NA,故B正确;
,58g氮气的物质的量为:$\frac{56g}{28g/mol}$=2mol,生成2mol氮气转移电子的物质的量为:15mol×$\frac{2}{4}$=7.5mol,转移电子数目为7.5NA,故B正确;
C.氢氧化铁胶体中,氢氧化铁胶粒为氢氧化铁的聚集体,无法计算胶体中含有的胶粒数,故C错误;
D.由于铁与浓硫酸在常温下发生钝化现象,则无法计算转移的电子数,故D错误;
故选AB.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,试题知识点较多、综合性较强,注意掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的转化关系,B为易错点,需要明确电子的转移情况.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 镁与盐酸反应放出氢气 | B. | 碳酸钙高温分解 | ||
| C. | 硫在空气或氧气中燃烧 | D. | Ba(OH)2•8H2O与NH4Cl反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 装置 | 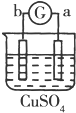 | 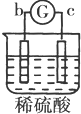 | 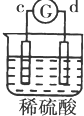 | 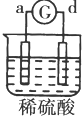 |
| 部分实验现象 | a极质量减小b极质量增加 | c极有气体产生 b极质量减轻 | d极溶解c极有气体产生 | 电流从a极流向d极 |
| A. | a>b>c>d | B. | b>c>d>a | C. | d>a>b>c | D. | a>b>d>c |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
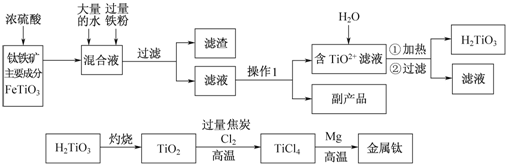
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 在进行中和滴定时,用标准酸溶液润洗酸式滴定管2~3次,用蒸馏水洗2~3次,效果更佳 | |
| B. | 基于硫代硫酸钠与稀硫酸反应生成S和SO2,在定量分析测定反应速率时,即可用S对标记遮盖发,也可用排水法测SO2体积,计算出相关的反应速率 | |
| C. | 燃料电池的制作:用包有薄海绵的两根碳棒做电极电解NaSO4溶液,一段时间后切断电源,在两极之间接上发光二极管,发现二极管发光 | |
| D. | 过滤、结晶、灼烧、萃取、分液和蒸馏等都是常用的分离混合物的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液肯定只存在NH4+、SO32- | |
| B. | 原溶液一定不含Ba2+、Fe3+、I- | |
| C. | 原溶液可能存在K+、SO42- | |
| D. | 另取试液滴加足量盐酸、BaCl2溶液,即可确定溶液离子组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

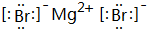
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验内容 | 实验目的 |
| A | 向盛有10滴0.1 mol•L-1AgNO3溶液的试管中滴加0.1mol•L-1 NaCl溶液,至不再有沉淀生成,再向其中滴加0.1mol•L-1 Na2S溶液 | 证明AgCl能转化为溶解度更小的Ag2S |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 证明该溶液中一定含有大量的SO42- |
| C | 向某卤代烃中加入NaOH溶液,加热一段时间后,加入AgNO3溶液 | 检验卤代烃中的卤素原子 |
| D | 向纯碱中滴加足量盐酸,将产生的气体通入苯酚钠溶液 | 证明酸性:盐酸>碳酸>苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com