
【题目】碳和硅是中学常见元素,其单质及化合物有独特的性质和用途。回答问题:
(1)基态碳原子的电子排布图为___,CO2属于___分子(选填“极性”或“非极性”);
(2)60克SiO2晶体中含有的Si-O键数目为___(用NA表示);
(3)有机物M(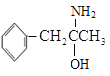 )中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
)中碳的杂化类型有__,除氢原子之外的其它元素原子的第一电离能由大到小的顺序为__;
(4)碳元素能形成多种单质如金刚石、石墨、C60等,回答下列问题:
(Ⅰ)C60的晶体类型是__晶体。
(Ⅱ)石墨是一种混合晶型,结构中具有的作用力有___。
a.共价键 b.分子间作用力 c.氢键 d.金属键 e.离子键
(Ⅲ)金刚石晶胞结构如图所示,假设金刚石晶胞的边长为a cm,阿伏伽德罗常数为NA,则金刚石的密度可以表示为___g/cm3。

【答案】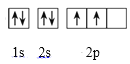 非极性 4NA sp2、sp3杂化 N>O>C 分子 abd
非极性 4NA sp2、sp3杂化 N>O>C 分子 abd ![]()
【解析】
(1)基态碳原子的电子排布式为1s22s22p2,其电子排布图为 ,CO2是直线形分子,正负电荷中心重合,属于非极性分子;
,CO2是直线形分子,正负电荷中心重合,属于非极性分子;
(2)60克SiO2晶体为1mol,在SiO2晶体中,每个硅原子都连有4个氧原子,所以1mol SiO2晶体含有的Si-O键数目为4NA;
(3) 中苯环上的碳原子是sp2杂化,支链上的碳原子是饱和碳原子,为sp3杂化;由于氮原子的2p上有3个电子,是稳定的半充满结构,失去一个电子比较困难,所以C、N、O的第一电离能由大到小的顺序为N>O>C;
中苯环上的碳原子是sp2杂化,支链上的碳原子是饱和碳原子,为sp3杂化;由于氮原子的2p上有3个电子,是稳定的半充满结构,失去一个电子比较困难,所以C、N、O的第一电离能由大到小的顺序为N>O>C;
(4)(Ⅰ)C60的晶体类型是分子晶体;
(Ⅱ)石墨是层状结构,在同层内,碳原子通过sp2杂化和另外三个碳原子形成共价键,层和层之间是微弱的范德华力,同时每个碳原子还有一个未杂化的电子,可以自由移动,所以石墨中具有的作用力有共价键、分子间作用力和金属键,故选abd;
(Ⅲ)一个金刚石晶胞中有8(=8×![]() +6×
+6×![]() +4×1)个碳原子,则一个晶胞的质量为
+4×1)个碳原子,则一个晶胞的质量为![]() g,所以金刚石的密度可以表示为
g,所以金刚石的密度可以表示为![]() g/cm3。
g/cm3。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】实验室制乙酸乙酯得主要装置如图中A所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;③小火加热a试管中的混合液;④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;⑤分离出纯净的乙酸乙酯。
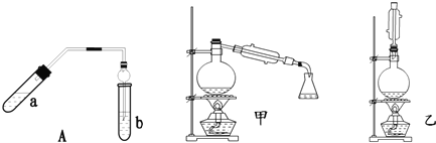
请回答下列问题:
(1)步骤①中,配制这一比例的混合液的正确操作是__;
(2)若实验中用含18O的乙醇与乙酸作用,该反应得化学方程式是:__;
(3)步骤③中,要用小火加热,其原因是__;
(4)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式:__;
(5)A装置中使用球形管除起到冷凝作用外,另一重要作用是__,步骤⑤中分离乙酸乙酯必须使用的一种仪器是__;
(6)为充分利用反应物,甲、乙两位同学分别设计了图中甲、乙两个装置(乙同学待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物),你认为合理的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铜是重要的化工原料,以下三种方法均可得到硝酸铜。
已知:2NO2+2NaOH=NaNO3+ NaNO2+H2O ,NO+NO2+2NaOH=2NaNO2+H2O(以下涉及到的气体体积均为标准状况下数据):
(1)甲组用a克Cu粉,在加热的条件下,与空气充分反应,然后将生成的CuO全部溶于VmL稀硝酸中,制得硝酸铜溶液,则所需稀硝酸的浓度至少为_______mol/L,需要质量分数为ω%,密度为ρg/cm3的浓硝酸_______mL(均用最简分式表示)。
(2)乙组用b克Cu粉,全部溶于过量的稀硝酸中,溶液质量增重_____克,将生成的气体通入足量NaOH溶液中并同时通入氧气的体积至少_______L才能使生成的气体吸收完全(均用最简分式表示)。
(3)丙组取某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。列式计算原混合酸中硝酸的物质的量是多少?____________硫酸的物质的量浓度多少?_________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CH4在一定条件下合成乙酸:CO2+CH4 ![]() CH3COOH。完成下列填空:
CH3COOH。完成下列填空:
(1)写出碳原子最外电子层的轨道表示式___________________________。
(2)钛(Ti)是22号元素,它是________________(选填编号)。
a.主族元素 b.副族元素 c.短周期元素 d.长周期元素
(3)CO2分子的电子式为__________________;其熔沸点比CS2低,原因是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香料G的一种合成工艺如下图所示。

已知:A的分子式为C5H8O,它有两种不同环境的氢原子。
CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
完成下列填空:
(1)A的结构简式为________________________________。
(2)D中官能团的名称为____________________________。
(3)检验M已完全转化为N的实验操作是___________________________________________。
(4)E与浓硫酸共热可制得H,H可制备一种高分子化合物Q。写出Q的结构简式_________。
(5)写出满足下列条件的L的两种同分异构体的结构简式(不考虑立体异构):__________。
①能发生银镜反应 ②能发生水解反应 ③苯环上的一氯代物有两种
(6)以1-丁醇和NBS为原料可以制备顺丁橡胶(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
)。请设计合成路线(其他无机原料任选)并用如下方式表示:_____________________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是
A.该合金中含有铝的质量至少为5.4 g
B.合金中镁的质量分数为63.3%≤Mg%<100%
C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2
D.在产生沉淀后的溶液中有1.5 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系正确的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均为水作还原剂的氧化还原反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
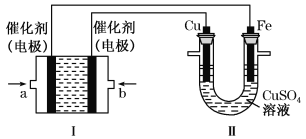
①a处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是______________;
②电镀结束后,装置Ⅰ中溶液的pH _________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度____________________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________________ ;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化6.4 g,则装置Ⅰ中理论上消耗甲烷__________L(标准状况下)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com