
| A. | 乙醇完全燃烧生成水 | |
| B. | 乙醇容易挥发 | |
| C. | 乙醇能与水以任意比例互溶 | |
| D. | 0.1mol乙醇与足量金属钠反应生成0.05molH2 |
科目:高中化学 来源: 题型:解答题
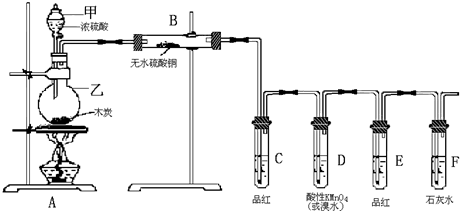
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该溶液中:Na+、SO42-、CH2O、Mg2+可以大量共存 | |
| B. | 该溶液中Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| C. | 与NaHCO3溶液混合:Fe3++3HCO3-=Fe(OH)3↓+3CO2↑ | |
| D. | 每腐蚀32gCu需要1mol/L该溶液500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①② | B. | 只有①③ | C. | 只有③④ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KI溶液中:Ca2+、Na+、ClO-、Cl- | |
| B. | 滴入酚酞试液显红色的溶液中:Al3+、K+、AlO2-、SO42- | |
| C. | c(H+)=10-12mol•L-1的溶液中:K+、Na+、NO3-、Cl- | |
| D. | 加入铝粉产生氢气的溶液中:Na+、Mg2+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将CO2通往入溶有少量氨的BaCl2溶液中,无白色沉淀生成 | |
| B. | 常温下,稀释0.1mol/L的醋酸,溶液中所有离子浓度均下降 | |
| C. | 等体积等浓度的CH3COOH与NaOH溶液混合后,溶液中离子浓度:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、M两种元素只能形成X2M型化合物 | |
| B. | 元素W和M的某些单质可作为水处理中的消毒剂 | |
| C. | 元素Y、Z、W的单质晶体属于同种类型的晶体 | |
| D. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com