
【题目】从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
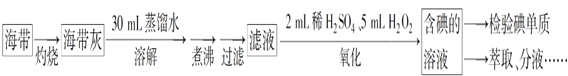
A. 灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒
B. 氧化过程中发生反应的离子方程式为 2I-+H2O2 =I2+2OH-
C. 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明海带中含有碘单质
D. 分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体
科目:高中化学 来源: 题型:
【题目】X(g)+3Y(g) ![]() 2Z(g)ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是
2Z(g)ΔH=-a kJ·molˉ1 ,一定条件下,将1 mol X和3 mol Y通入2L的恒容密闭容器中,反应10min,测得Y的物质的量为2.4 mol。下列说法正确的是
A.10min内,Y的平均反应速率为0.03 mol·Lˉ1·sˉ1
B.第10min时,X的反应速率为0.01 mol·Lˉ1·minˉ1
C.10min内,消耗0.2 mol X,生成0.4 mol Z
D.10min内,X和Y反应放出的热量为a kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156 --157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃,从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺如图所示:

(l)对青蒿干燥破碎后,加入乙醚的目的是_________________。
(2)操作I需要的玻璃仪器主要有烧杯、 ___,操作Ⅱ的名称是___________。
(3)操作Ⅲ的主要过程可能是____(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)在用分液漏斗进行分液操作时,为使液体顺利滴下,应进行的具体操作是____,再将分液漏斗下面的活塞拧开,使下层液体慢慢沿 烧杯壁流下。分液后漏斗内剩余的液体从分液漏斗的 ___(填“上口”或 “下口”)倒入烧杯。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂,工业上可用NO与Cl2合成,回答下列问题:
(1)—定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及热化学方程式和平衡常数如下表:
序号 | 热化学方程式 | 平衡常数 |
① | 2NO2(g) +NaCl(s) | K1 |
② | 4NO2(g) +2NaCl(s) | k2 |
③ | 2NO(g)+Cl2(g) | K3 |
K3=_______(用K1、K2表示)。
(2)25℃时,向体积为2L且带气压计的恒容密闭容器中通入0.08molNO和0.04molCl2发生反应:2NO(g)+Cl2(g) ![]() 2ClNO(g) △H3。
2ClNO(g) △H3。
① 下列描述能说明该反应已达到平衡状态的是_____(填序号)
a.v正(Cl2)=2v逆(NO) b.容器内混合气体的密度保持不变
c.容器内气体压强保持不变 d.容器内混合气体的平均相对分子质量保持不变
②若反应起始和平衡时温度相同,测得反应过程中压强(P)随时间(t)的变化如图I曲线a所示,则△H3______0(填“ >”、“ < ”或“不确定");若其他条件相同,仅改变某一条件时,测得其压强(P)随时间(t)的变化如图I曲线b所示,則改变的条件是_________。
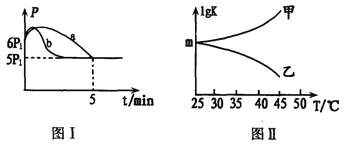
③图II是甲、乙同学描绘上述反应平衡常数的对数值(lgK)与温度的变化关系,其中正确的曲线是____(填“甲”或“乙”);m值为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代硫酸的制法是隔绝空气锻烧绿矾(FeSO47H2O),将蒸气冷却可制得一种无色粘稠的液体“绿矾油”,剩余的固体为红棕色。已知SO3的熔点是16.8°C,沸点是44.8°C,在加热条件下SO3具有比较强的氧化性。完成下列各空:
(1)绿矾油中溶质的化学式为_________。
(2)用下图装置煅烧绿矾并检验气体产物,煅烧一段时间后,发现D中U型管出现无色粘稠的液体,B中品红溶液褪色。

① 上述装置正确的连接顺序是A→(_______________________)(用大写字母表示)。
② 写出煅烧绿矾的化学方程式_________。
(3)绿矾在空气中部分被氧化为硫酸铁,现取3.66g绿巩样品溶于稀盐酸,加人足贵的BaCl2溶液,过滤得沉淀4.66g,向溶液中通入56mL(标准状况)氯气恰好将Fe2+完全氧化,计算变质后的绿矾晶体中n(Fe3+):n(Fe2+)为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】200℃时将 16.0g NaOH 和 NaHCO3 的混合物放在密闭容器中加热到质量不再减少为止,称得剩 余固体质量为 14.8g,试回答:
(1)剩余固体的化学式是__________。
(2)原混合物中 NaOH 的质量分数__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为长式周期表的一部分,其中的编号代表对应的元素。
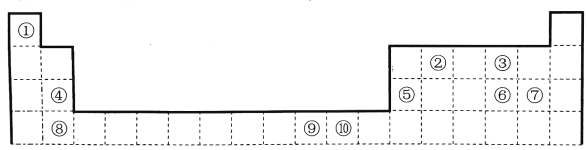
请回答下列问题:
(1)元素⑩的基态原子的价电子排布式为_________________。
(2)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是________。
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp'-s的δ键和1个P-P的π键
D.该氢化物分子中②原子采用sp2杂化
(3)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有________(填序号)。
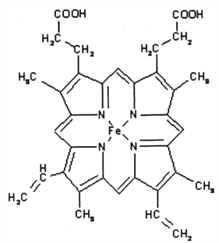
A.离子键 B.金属键 C.极性键 D.非极性键 E.配位键 F.氢键G. δ键 H.兀键
(4)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是______(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子结构与元素周期表存在着内在联系,根据已学知识请你回答下列问题。
(1)指出31号元素镓(Ga)在元素周期表中的位置:第_______周期______族。
(2)写出原子序数最小的Ⅷ族元素原子的核外电子排布式:_____________________________。
(3)写出3p轨道上只有2个未成对电子的元素的符号:________、________,二者电负性________>________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com