
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 25 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 20 | 0.152 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下铝与浓硫酸不发生反应,故常温下可用铝制容器贮运浓硫酸 | |
| B. | 碳酸钠可与盐酸反应,故常用于治疗胃溃疡病人的胃酸过多症 | |
| C. | 氧化铝具有很高的熔点,故可用于制造阻燃剂或耐高温材料 | |
| D. | 二氧化硫、潮湿的氯气均具有漂白性,故其混合物的漂白效果会更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性随原子电子层数的增加而增加 | |
| B. | 在空气中燃烧的生成物都是过氧化物 | |
| C. | 与水反应的剧烈程度随核电荷数增加而增强 | |
| D. | 最高价氧化物对应水化物的碱性随核电荷数增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 晶体熔点由低到高:CF4<CCl4<CBr4<CI4 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaI>NaBr>NaCl>NaF |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
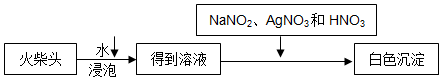
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com