
| A. | 11.2升 | B. | 3.36升 | C. | 2.24升 | D. | 1.12升 |
分析 发生反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、Ag++Cl-=AgCl↓,根据氯原子守恒计算.
解答 解:n(AgCl)=$\frac{57.4g}{143.5g/mol}$=0.4mol,
n(HCl)=0.05L×10mol/L=0.5mol,
由MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O、Ag++Cl-=AgCl↓可知,
2HCl~Cl2↑
2 1
制得氯气的体积为(0.5mol-0.4mol)×$\frac{1}{2}$×22.4L/mol=1.12L,
故选D.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的反应及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
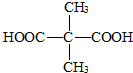 .
.
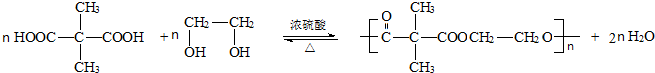 反应类型:缩聚反应.
反应类型:缩聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
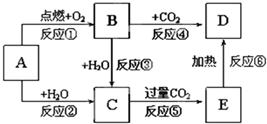
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 置换反应一定是氧化还原反应 | B. | 化合反应一定是氧化还原反应 | ||
| C. | 中和反应一定是氧化还原反应 | D. | 复分解反应一定是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅太阳能电池工作时将光能转化为电能 | |
| B. | 物质之间发生化学反应时都会伴随着能量变化 | |
| C. | 催化剂虽然能降低反应的活化能,但不能改变反应的焓变 | |
| D. | 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com