
| A. | 在滴定操作中,滴定管和锥形瓶都需要用待装溶液润洗 | |
| B. | 酸性溶液中,Fe2+、SO2-4、K+、NO-3能大量共存 | |
| C. | SO2具有漂白性,将其通人石蕊溶液中,溶液先变红后褪色 | |
| D. | 常用丁达尔效应区分溶液和胶体 |
分析 A、锥形瓶不能润洗,否则导致待测液中溶质的物质的量偏大;
B、酸性溶液中硝酸根离子能氧化亚铁离子;
C、二氧化硫的水溶液是亚硫酸,具有酸性,二氧化硫具有漂白性,但是不能使指示剂褪色;
D、胶体具有丁达尔现象,而溶液不具有.
解答 解:A、滴定过程中,锥形瓶不能润洗,否则会导致锥形瓶中待测液的溶质的物质的量偏大,标准液体积偏大,测定结果偏高,故A错误;
B、酸性条件下Fe2+、NO3-能发生氧化还原反应,则不能共存,故B错误;
C、二氧化硫的水溶液是亚硫酸,具有酸性,SO2可使石蕊溶液变红,不能使指示剂褪色,故C错误;
D、胶体具有丁达尔现象,而溶液不具有,则可用丁达尔效应区分溶液和胶体,故D正确;
故选D.
点评 本题考查物质的性质、离子的共存以及中和滴定,明确物质的性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
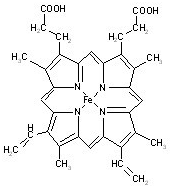 血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图.
血红素是血红蛋白分子上的主要稳定结构,为血红蛋白、肌红蛋白的辅基,其分子结构如图. )中有3个手性碳原子.
)中有3个手性碳原子.查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上10月月考化学试卷(解析版) 题型:选择题
隐形眼镜越来越受到年青人的喜爱,在使用隐形眼镜时,常用的护理药水中含有过氧化氢(H2O2).下列有关过氧化氢的说法中正确的是
A.过氧化氢是由氢气和氧气组成的
B.它是由2个氢元素和2个氧元素组成的
C.过氧化氢在二氧化锰作用下能生成水和氧气,该反应为复分解反应
D.每个过氧化氢分子中含有2个氢原子和2个氧原子
查看答案和解析>>
科目:高中化学 来源:2016-2017学年西藏拉萨中学高二上第一次月考化学试卷(解析版) 题型:选择题
在化学反应A(g)+3B(g)  2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
A.v(A)=v(B) B.v(A)=2v(C) C.3v(B)=v(C) D.v(B)=3v(D)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高一上9月调研化学试卷(解析版) 题型:填空题
(一题多变题组)关于物质的量各物理量之间的相互转化
(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为___________;同质量的氨气和硫化氢气体的物质的量比为_____________,所含原子个数比为__________;若两者所含氢原子数相等,它们的物质的量比是_____________。
(2)标准状况下,①4 g氢气、② 33.6 L甲烷、③ 6.02×10 23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
23个水分子中,含分子数最多的是(填序号,下同)________,含原子数最多的是________,质量最大的是________,体积最小的是______。
(3)现有质量为a g某气体A2B,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:该气体的物质的量为_____ ___mol,该气体所含原子总数为___ ____个,该气体在标准状况下的体积为____________L。
(学法题)通过解答本题,在解题时应先将各种已知量转化为 再进行计算。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 3.48 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 1.58 | 158 |
| 硝酸银 | 0.02 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
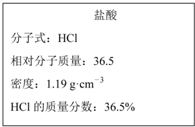 如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签的有关内容,试根据标签上的有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中和10mL 1 mol•L-1 CH3COOH溶液需要10 mL 1 mol•L-1 NaOH溶液 | |
| B. | 物质的量浓度相同时,锌粒跟盐酸反应的速率比跟醋酸反应的速率快 | |
| C. | 0.01mol•L-1醋酸溶液的pH大于2 | |
| D. | 0.1mol•L-1 CH3COONa溶液显碱性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com