
| A. | 金刚石,晶体硅,碳化硅 | B. | CI4>CBr4>CCl4>CH4 | ||
| C. | MgO>CsCl>NaCl | D. | Na>Mg>Al |
分析 A.原子晶体中,熔沸点高低与键长成反比;
B.分子晶体中,熔沸点与相对分子质量成正比;
C.离子晶体中,熔沸点与电荷成正比、与离子半径成反比;
D.金属晶体中,熔沸点与半径成正比.
解答 解:A.原子晶体中,熔沸点高低与键长成反比,这几种物质都是原子晶体,键长C-C<C-Si<Si-Si,所以熔沸点金刚石>碳化硅>晶体硅,故A错误;
B.分子晶体中,熔沸点与相对分子质量成正比,相对分子质量CI4>CBr4>CCl4>CH4,所以熔沸点CI4>CBr4>CCl4>CH4,故B正确;
C.离子晶体中,熔沸点与电荷成正比、与离子半径成反比,镁离子和氧离子都两个单位电荷,钠离子、铯离子和氯离子都带一个单位电荷,且铯离子半径大于钠离子,所以熔沸点MgO>NaCl>CsCl,故C错误;
D.金属晶体中,熔沸点与半径成正比,半径Na>Mg>Al,所以熔沸点Al>Mg>Na,故D错误;
故选B.
点评 本题考查离子晶体、原子晶体、金属晶体、分子晶体熔沸点高低判断,侧重考查知识运用,明确晶体类型及晶体熔沸点高低影响因素即可解答,题目难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:解答题
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中 | 试管A中不再产生气泡 试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液 | 试管A、B中均未见气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某实验过程中得到一定量的碘水,可用裂化汽油从碘水中萃取出碘 | |
| B. | 芳香烃主要来自于煤焦油和石油化工中的催化重整 | |
| C. | 常压分馏得到的汽油是混合物,没有固定的沸点 | |
| D. | 乙烯是轻质油裂解的产物,其产量可用来衡量一个国家的石油化工发展水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
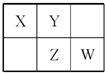 四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍.
四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍. (写结构式);
(写结构式); ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3与盐酸的反应是放热反应 | |
| B. | 该反应中,热能转化为产物内部的能量 | |
| C. | 反应物的总能量高于生成物的总能 | |
| D. | 该反应的反应物和生成物的能量高低与醋酸的凝固无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸铷是离子化合物 | |
| B. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| C. | 氢氧化铷是弱碱 | |
| D. | 它位于周期表的第四周期、第ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 它位于周期表的第五周期,第I A族 | |
| B. | 氢氧化铷是弱碱 | |
| C. | 在钠、钾、铷3种单质中,铷的熔点最高 | |
| D. | 硝酸铷是离子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com