
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟。下图是钒电池基本工作原理示意图:
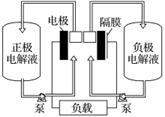
请回答下列问题:
(1)硫酸在电池技术和实验室中具有广泛的应用,在传统的铜锌原电池中,硫酸是____________,实验室中配制硫酸亚铁时需要加入少量硫酸,硫酸的作用是____。
(2)钒电池是以溶解于一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO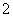 )为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O
)为正极和负极电极反应的活性物质,电池总反应为VO2++V3++H2O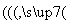 V2++VO
V2++VO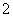 +2H+。放电时的正极反应式为______________________________________________________,充电时的阴极反应式为______________________________________。放电过程中,电解液的pH________(填“升高”、“降低”或“不变”)。
+2H+。放电时的正极反应式为______________________________________________________,充电时的阴极反应式为______________________________________。放电过程中,电解液的pH________(填“升高”、“降低”或“不变”)。
(3)钒电池基本工作原理示意图中“正极电解液”可能是________(填字母)。
a.VO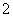 、VO2+混合液 b.V3+、V2+混合液
、VO2+混合液 b.V3+、V2+混合液
c.VO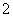 溶液 d.VO2+溶液
溶液 d.VO2+溶液
e.V3+溶液 f.V2+溶液
(4)能够通过钒电池基本工作原理示意图中“隔膜”的离子是_________________________。
答案 (1)电解质溶液 抑制硫酸亚铁的水解
(2)VO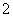 +2H++e-===VO2++H2O V3++e-===V2+ 升高 (3)acd (4)H+
+2H++e-===VO2++H2O V3++e-===V2+ 升高 (3)acd (4)H+
解析 (1)传统的铜锌原电池中,锌与酸反应生成氢气,故硫酸为电解质溶液;硫酸亚铁容易水解,且水解显酸性,加入少量硫酸,可以抑制其水解变质。
(2)正极反应是还原反应,由电池总反应可知放电时的正极反应为VO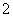 +2H++e-===VO2++H2O;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应。
+2H++e-===VO2++H2O;充电时,阴极反应为还原反应,故为V3+得电子生成V2+的反应。
(3)充电时阳极反应式为VO2++H2O-e-===VO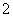 +2H+,故充电完毕的正极电解液为VO
+2H+,故充电完毕的正极电解液为VO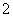 溶液,而放电完毕的正极电解液为VO2+溶液,故正极电解液可能是选项a、c、d。
溶液,而放电完毕的正极电解液为VO2+溶液,故正极电解液可能是选项a、c、d。
(4)充电和放电过程中,正极电解液与负极电解液不能混合,起平衡电荷作用的是加入的酸,故H+可以通过隔膜。


科目:高中化学 来源: 题型:
用下图所示装置及药品进行相应实验,能达到实验目的的是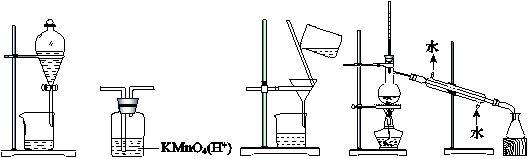
|
| A.图1 分离乙醇和乙酸 | B.图2 除去乙炔中的乙烯 |
| C.图3 除去溴苯中的溴单质 | D.图4 除去工业酒精中的甲醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
能量之间可相互转化:电解食盐水制备Cl2是将电能转化为化学能,而原电池可将化学能转化为电能。设计两种类型的原电池,探究其能量转化效率。限选材料:ZnSO4(aq),FeSO4(aq),CuSO4(aq);铜片,铁片,锌片和导线。
①完成原电池甲的装置示意图(见下图),并作相应标注,要求:在同一烧杯中,电极与溶液含相同的金属元素。
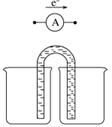
②以铜片为电极之一,CuSO4(aq)为电解质溶液,只在一个烧杯中组装原电池乙,工作一段时间后,可观察到负极__________。
③甲乙两种原电池可更有效地将化学能转化为电能的是________,其原因是____________。
④根据牺牲阳极的阴极保护法原理,为减缓电解质溶液中铁片的腐蚀,在上述的材料中应选__________作阳极。
通过NOx传感器可监测NOx的含量,其工作原理示意图如下:
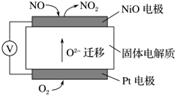
①Pt电极上发生的是________反应(填“氧化”或“还原”)
②写出NiO电极的电极反应式:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
A.电流从左侧电极经过负载后流向右侧电极
B.负极发生的电极反应式为N2H4+4OH--4e-===N2+4H2O
C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
硒(Se)与硫在元素周期表中位于同一主族。下列说法不正确的是
A.原子半径:Se > S B.沸点:H2S > H2Se
C.稳定性:H2S > H2Se D.酸性:H2SO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
某二次电池充、放电的化学方程式为:2K2S2+KI3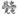 K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
K2S4+3KI。与其它设备连接的电路如图示。当闭合开关K时,X附近溶液先变红。则下列说法正确的是
A. K+从右到左通过离子交换膜
B. A的电极反应式为:3I--2e-= I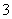
C.当有0.1 mol K+通过离子交换膜,X电极上产生气体1.12 L(标准状况下)
D.电池充电时,B电极要与外电源的正极相连,电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法错误的是
A、主族元素的最外层电子数都等于它的最高正化合价
B、同一主族的元素的原子最外层电子数相等
C、同周期的主族元素随核电荷数的递增原子半径逐渐减小
D、第N周期有N种主族元素是金属元素(N>1)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com