
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
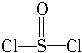 )中形成的,电池总反应方程式为:8Li+3SOCl2
)中形成的,电池总反应方程式为:8Li+3SOCl2A.若电解质溶液中混入水,对电池反应无影响?
B.金属锂作电池的正极,石墨作电池的负极?
C.电池工作过程中,亚硫酰氯(SOCl2)被还原为S?
D.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知亚硫酰氯(SOCl2)溶于水产生大量白雾和刺激性气味气体.有一种锂电池,用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S。下列有关叙述中,正确的是
A.锂为电池的正极,石墨作电池的负极
B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
C.电解质溶液中混入水,对电池反应无影响
D.电池工作过程中,锂提供的电子与正极区析出硫的物质的量之比为4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硫酰氯(SOCl2)是重要的有机物卤化剂和电池的介质,生产上和生活中有着广泛应用,亚硫酰氯易水解,在140℃以上可发生:4SOCl2=3Cl2↑+2SO2↑+S2Cl2。有关说法不正确的是
A.1mol SOCl2受热分解,转移2mol电子
B.S2Cl2分子中各原子均达到八电子结构
C.气态产物通入品红溶液中,一定能使品红溶液褪色
D.工业上用ZnCl2·6H2O与SOCl2混合制无水氯化镁,是利用SOCl2水解释放出HCl,
抑制氯化锌的水解
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市嘉定区高三上学期期末教学质量调研化学试卷(解析版) 题型:实验题
二氯化硫(SCl2)熔点-78℃,沸点59℃,密度1.638g/mL,遇水易分解,二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是氯气与硫合成二氯化硫的实验装置。
试回答下列问题:
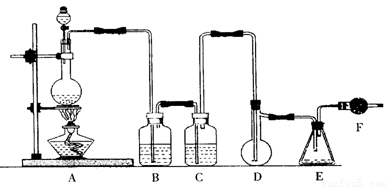
(1)装置A中发生反应的化学方程式为 。
(2)装置B、C应盛放的药品分别是 、 。
(3)实验开始前先在D中放一定量的硫粉.加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50—59℃.最好采用的措施是 、如何防止E中液体挥发? 。
(5)F装置中干燥管内所盛物质是 ,作用是 。
(6)由二氯化硫与SO3作用生成亚硫酰氯的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届福建莆田一中高二下学期第一学段考试化学试卷(1)(解析版) 题型:选择题
有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯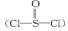 中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
中形成的,电池总反应方程式为:8Li+3SOCl2====6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A.电池工作过程中,金属锂提供的电子与正极区析出硫的物质的量之比为4∶1
B.电解质溶液中混入碱溶液,对电池反应无影响
C.电池的正极为:Li-e-====Li+
D.电池工作过程中,亚硫酰氯(SOCl2)仅被还原为Li2SO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com