
| 分类 组合 | 纯净物 | 盐 | 碱性氧化物 | 酸性氧化物 |
| A | 碱石灰 | 纯碱 | 氧化铝 | 二氧化碳 |
| B | 盐酸 | 小苏打 | 氧化镁 | 二氧化氮 |
| C | H2O2 | 苏打 | 过氧化钠 | 二氧化硫 |
| D | 五水合硫酸铜 | 碱式碳酸铜 | 氧化钠 | 三氧化硫 |
| A、A | B、B | C、C | D、D |


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
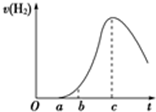 将在空气中久置的铝片与0.5mol?L-1硫酸反应,产生氢气的速率与反应时间可用如图所示的曲线表示,试回答下列问题.
将在空气中久置的铝片与0.5mol?L-1硫酸反应,产生氢气的速率与反应时间可用如图所示的曲线表示,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含氧原子个数比为2:3 |
| B、含硫元素质量比为4:5 |
| C、含硫原子个数比为1:1 |
| D、含氧元素质量比为5:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是一种物理量 |
| B、1 mol CO2的质量是44 g/mol |
| C、标准状况下的气体摩尔体积约占22.4 L |
| D、某条件下,单位物质的量的气体所占的体积就是该条件下的气体摩尔体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙跟醋酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ |
| B、硫酸铝溶液中加过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、向足量的溴化亚铁溶液中通入少量的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、碳酸氢钠溶液与足量的氢氧化钡溶液混合:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
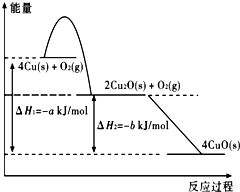 铜及其化合物在工业、农业、科技和日常生活中有广泛应用.
铜及其化合物在工业、农业、科技和日常生活中有广泛应用.| 已生锈的金属质量 |
| 金属的总质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ/mol,则反应物总能量大于生成物总能量 |
| B、若一定条件下,A═B△H<0,说明A物质比B物质稳定 |
| C、101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol,则H2的燃烧热为571.6 kJ/mol |
| D、H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,含1 molNaOH的溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com