
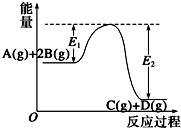
| A、该反应为吸热反应 |
| B、当反应达到平衡时,降低温度,A的转化率减小 |
| C、升高温度,平衡常数K增大;压强增大,平衡向正反应方向移动 |
| D、加入催化剂,反应速率增大,E1减小,E2减小,反应热不变 |


科目:高中化学 来源: 题型:
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
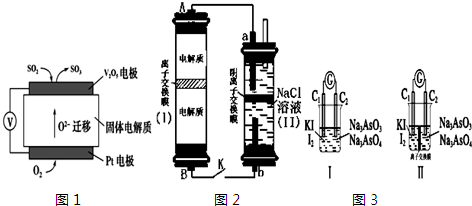
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA |
| B、78g过氧化钠中含阴离子数为2 NA |
| C、C2H4和N2组成的42g混合气体中原子的个数为3 NA |
| D、5NH4 NO3═2HNO3+4N2↑+9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
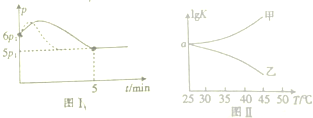
查看答案和解析>>
科目:高中化学 来源: 题型:
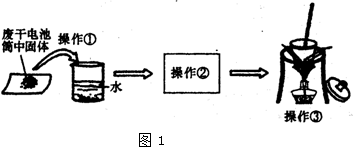 日常生活中使用的锌锰干电池,电池外壳是锌片,中心是石墨棒,在外壳和石墨之间填充二氧化锰和碳粉以及氯化锌及氯化铵的糊状物.某研究性学习小组对干电池的填充物质进行了如图1实验.
日常生活中使用的锌锰干电池,电池外壳是锌片,中心是石墨棒,在外壳和石墨之间填充二氧化锰和碳粉以及氯化锌及氯化铵的糊状物.某研究性学习小组对干电池的填充物质进行了如图1实验.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com