
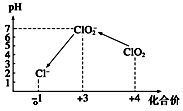
 二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
二氧化氯是一种黄绿色到橙黄色的气体,被国际上公认为安全、低毒的绿色消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.分析 (1)结合氧化还原反应中化合价升降相等,判断ClO2中Cl元素化合价变化,元素化合价升高表现还原性,元素化合价降低表现氧化性;
(2)酸性溶液中用草酸(H2C2O4)还原氯酸钠(NaClO3),发生氧化还原反应,遵循电子、电荷守恒;
(3)设物质的量均为1mol,则ClO2、Cl2的转化为Cl-得到电子分别为5mol、2mol;
(4)①操作Ⅰ中ClO2与KI发生氧化还原反应;
②操作Ⅱ:加入一定量的Na2S2O3溶液,发生2S2O32-+I2═S4O62-+2I-,蓝色消失;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2与淀粉结合再次出现蓝色,根据化合价升降总数相等、原子守恒和电荷守恒来配平;
④根据关系S2O32-~I-~ClO2先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)反应中Fe元素、Mn元素化合价升高,根据化合价升降相等,ClO2中Cl元素化合价降低,表现氧化性,
故答案为:氧化;
(2)酸性溶液中用草酸(H2C2O4)还原氯酸钠(NaClO3),离子反应为H2C2O4+2ClO3-+2H+=2CO2↑+2ClO2↑+2H2O,遵循电荷、电子守恒,
故答案为:H2C2O4+2ClO3-+2H+=2CO2↑+2ClO2↑+2H2O;
(3)设物质的量均为1mol,则ClO2、Cl2的转化为Cl-得到电子分别为5mol、2mol,则相同物质的量的ClO2的消毒效率是Cl2的$\frac{5mol}{2mol}$=2.5倍,
故答案为:2.5;
(4)①操作Ⅰ中ClO2与KI发生氧化还原反应,离子反应为2ClO2+2I-═2ClO2+I2,
故答案为:2ClO2+2I-═2ClO2+I2;
②操作Ⅱ:加入一定量的Na2S2O3溶液,发生2S2O32-+I2═S4O62-+2I-,蓝色消失,则确定操作Ⅱ完全反应的现象是蓝色恰好消失,
故答案为:蓝色恰好消失;
③由图示表明,pH至1~3时,ClO2-将I-氧化成I,生成的I2,离子方程式为:ClO2-+4I-+4H+=Cl-+2I2+2H2O,
故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④S2O32-~I-~ClO2
1 1 1
1.0×10-3 mol/L×0.01L 1.0×10-5mol
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg
由于水样为 1L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1
故答案为:0.675.
点评 本题考查物质含量的测定,为高频考点,把握发生的氧化还原反应、反应的计算为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的应用,题目难度中等.


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )
室温下向10mL 0.1mol•L-1 NaOH溶液中加入 0.1mol•L-1的一元酸HA,溶液pH的变化曲线如图所示.下列说法正确的是( )| A. | a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) | |
| B. | a、b两点所示溶液中水的电离程度:a>b,且a点所示溶液中由水电离出的c(OH-)=10-8.7mol/L | |
| C. | pH=7时溶液中c(HA)>c(Na+)=c(A-)>c(H+)=c(OH-) | |
| D. | b点所示溶液中c(A-)>c(HA) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
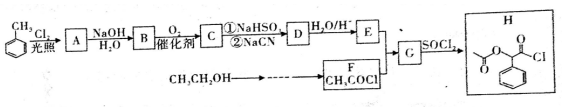

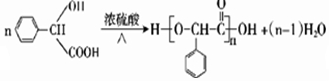 .
.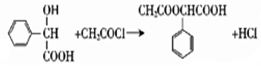 .
.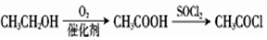 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com