
| A. | pH=2的HA溶液与pH=12的MOH碱溶液以任意比混合:c(H+)+c(M+)═c(OH-)+c(A-) | |
| B. | 0.1mol•L-1Na2SO3溶液:c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) | |
| C. | 等浓度、等体积的Na2CO3和NaHCO3混合溶液:$\frac{c{(HCO}_{3}^{-})}{c({H}_{2}C{O}_{3})}>$$\frac{c{(CO}_{3}^{2-})}{c{(HCO}_{3}^{-})}$ | |
| D. | 0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(CL-) |
分析 A.混合液中一定满足电荷守恒,根据电荷守恒判断溶液中离子浓度关系;
B.溶液中一定满足物料守恒,根据亚硫酸钠溶液中的物料守恒进行判断;
C.等浓度的碳酸钠、碳酸氢钠溶液中,褪色酸性大于碳酸氢根离子,则碳酸钠的水解程度大于碳酸氢钠,碳酸钠溶液中的氢氧根离子浓度大于碳酸氢根离子,据此进行判断;
D.溶液中存在电荷守恒,氯化钙溶液中性,0.1mol•L-1CH3COONa溶液中存在质子守恒,据此计算分析判断.
解答 解:A.pH=2的HA酸溶液与pH=12的MOH碱溶液以任意比混合,无论溶液如何反应,混合液一定满足电荷守恒:c(H+)+c(M+)=c(OH-)+c(A-),故A正确;
B.0.1mol/LNa2SO3溶液中一定满足物料守恒,根据物料守恒可知,亚硫酸氢根离子的系数应该为2,正确的物料守恒为:c(Na+)=2c(SO32-)+2c(HSO3-)+2c(H2SO3),故B错误;
C.等浓度、等体枳的Na2CO3和NaHCO3混合,根据碳酸钠、碳酸氢钠溶液中的水解平衡常数可知:c(OH-)=$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$、c(OH-)=$\frac{c(C{{O}_{3}}^{2-})}{(HC{{O}_{3}}^{-})}$,由于碳酸钠溶液中的氢氧根离子浓度大于碳酸氢钠,则:$\frac{c(HC{{O}_{3}}^{-})}{c({H}_{2}C{O}_{3})}$>$\frac{c(C{{O}_{3}}^{2-})}{(HC{{O}_{3}}^{-})}$,故C正确;
D.0.1mol•L-1CH3COONa溶液与0.1mol•L-1CaCl2溶液等体积混合:电荷守恒:c(Na+)+c(Ca2+)+c(H+)=c(CH3COO-)+c(OH-)+c(Cl-),0.1mol•L-1CH3COONa溶液中存在质子守恒,c(H+)=c(CH3COO-)+c(CH3COOH),得到c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+c(Cl-),故D错误;
故选AC.
点评 本题考查了离子浓度大小比较、盐的水解原理的综合应用,题目难度中等,注意掌握盐的水解原理,能够根据电荷守恒、物料守恒、盐的水解原理等知识判断溶液中各离子浓度大小.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 有单质参加的化学反应一定是氧化还原反应 | |
| B. | 有单质生成的分解反应一定是氧化还原反应 | |
| C. | 某种物质中只含有一种元素一定是纯净物 | |
| D. | 酸和盐一定能发生复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢气还原氧化铜 | |
| B. | 二氧化碳与氢氧化钠溶液作用生成碳酸氢钠 | |
| C. | 硫化氢通入氯化铁溶液中生成硫、氯化亚铁和盐酸 | |
| D. | 氯酸钾分解制氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量之比为1:1 | B. | 质量之比为4:1 | ||
| C. | 物质的量之比为l:2 | D. | 质量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
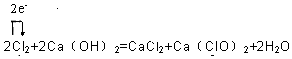 ,并用单线桥表示该反应电子转移的方向和数目.
,并用单线桥表示该反应电子转移的方向和数目. (任填一种物质的电子式)
(任填一种物质的电子式)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热能要充分利用 | |
| B. | 充足的空气就是指空气的量越大越好 | |
| C. | 固体燃料燃烧前要粉碎 | |
| D. | 液体燃料燃烧时可以雾状喷出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )
X、Y、Z、W、Q是原子序教依次增大的五种短周期主族元素.其中只有Z是金属,W的单质是黄色固体,X、Y、W在周期表中的相对位里关系如图.下列说法正确的是( )| A. | 五种元素中,原子半径最大的是W | |
| B. | Y的氢化物的沸点比W的氢化物的沸点低 | |
| C. | Y与Z 形成的化合物都可以和盐酸反应 | |
| D. | Z与Q形成的化合物的水解液一定显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | |||
| W | Z |
| A. | 最高价氧化物的水化物的酸性:X<Z | |
| B. | 电负性大小:Y<Z | |
| C. | 离子半径大小:W<Y | |
| D. | W的最高价氧化物的水化物具有两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com