
【题目】工业合成氨反应的能量变化如图所示. 
(1)写出合成氨反应的热化学方程式:
(2)在甲乙两个体积均为2L固定容积的密闭容器中,分别充入甲:1molN2、3molH2和乙:1molN2、3molH2、1molHe,(其它条件相同),反应速率甲乙(填大于、小于或等于),经过足够长的时间后在甲容器中该反应放出的热量(或吸收的热量)92.4kJ(填“大于”、“小于”或“等于”)
(3)下列图象分别代表焓变(△H )、混合气体平均相对分子质量( ![]() )、N2体积分数
)、N2体积分数
φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是 . 
【答案】
(1)N2(g)+3H2(g)?2NH3(g)△H=﹣92.4kJ/mol
(2)等于;小于
(3)BC
【解析】解:(1)△H=反应物的活化能﹣生成物的活化能,﹣92.4KJ/mol=E1﹣E2 , 该热化学方程式为N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol;
所以答案是:N2(g)+3H2(g)2NH3(g)△H=﹣92.4kJ/mol;(2)反应容器体积不变,加入不相关的气体,相关气体浓度不变,反应速率相等;合成氨为可逆反应,反应物不能完全转化,放热少,所以答案是:等于;小于;)(3)A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B.随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C.随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D.容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
所以答案是:BC.
【考点精析】掌握化学平衡状态的判断是解答本题的根本,需要知道状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.


科目:高中化学 来源: 题型:
【题目】一种烯醇结构简式为CH2=CHCH2OH下列说法正确的是( )
A.该物质与乙醇互为同系物B.该物质常温下呈气态
C.该物质与CH3CH2CHO互为同分异构体D.该物质能与盐酸发生中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铅蓄电池电解苦卤水 (含C1﹣、Br﹣、Na+、Mg2+)的装置如图所示 (a、b为石墨电极).下列说法中正确的是( ) 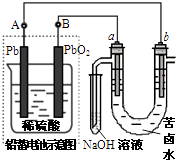
A.铅蓄电池负极的反应式为:Pb﹣2e ﹣→Pb2+
B.铅蓄电池放电时,该电池两极质量均减少
C.铅蓄电池充电时,B极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是( ) 
A.一定条件下,X和Y反应生成Z,由图1推出该反应的方程式可表示为:X+3YZ
B.图2表示NaOH溶液滴加到0.1 mol/L的一元酸溶液得到的滴定曲线(常温下),该实验最好选取酚酞作指示剂
C.常温下,向NaOH溶液中逐滴加入等浓度的醋酸溶液,所得滴定曲线如图3所示.当7<pH<13时,溶液中c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
D.用硝酸银溶液滴定等浓度的A﹣、B﹣、C﹣的混合溶液(均可以与Ag+反应生成沉淀),由图4可确定首先沉淀的是A﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-===Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质溶液
D.放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
(1)已知反应N2O4(g)2NO2(g)△H,随温度升高,混合气体的颜色变深.将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况.
下列说法能说明透光率不再发生改变的有 .
a.气体颜色不再改变 b.△H不再改变
c.v正(N2O4)=2v逆(NO2) d.N2O4的转化率不再改变
(2)用NH3催化还原NOx可以消除氮氧化物的污染.如图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO2(g)+2NH3(g)2N2(g)+3H2O(g).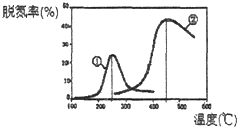
①该反应的△S0(填“>”、“=”或“<”).
②以下说法正确的是 .
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.
已知:CH4(g)的燃烧热为890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量.
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1114kJ/mol
2NO(g)+O2(g)═2NO2(g)△H=﹣114kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式: .
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)= .
②T1T2(填“>”或“<”,下空同);判断理由是 .
③T1℃时,反应CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)平衡常数K=
④温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2 , 达新平衡时CH4的转化率将 (填“增大”、“减小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂.
用盐酸滴定待测液NaOH,滴定终点时的颜色变化是;若滴定前平视读数,滴定终点时俯视读数,则会使所测NaOH溶液的浓度值(填“无影响”、“偏高”或“偏低”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“物质的量”是联系宏观世界和微观世界的桥梁。下列说法正确的是
A. 任何气体的“气体摩尔体积”均为22.4L/mol
B. 1molO2的质量是32g/mol
C. “摩尔”是 “物质的量”的单位
D. 10mL2mol/LH2SO4溶液中取出的5mL溶液,其浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2 , 将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L. 
①B中可通过判断可逆反应2NO2N2O4已经达到平衡.
②若平衡后在A容器中再充入0.5mol N2O4 , 则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”“变小”或“不变”).
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于
④若打开K2 , 平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为L.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com