
下列有关叙述正确的是
A.常温时,某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1x 10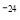 ,该溶液中一定可以大量存在K+、Na+、ClO-、SO42-。
,该溶液中一定可以大量存在K+、Na+、ClO-、SO42-。
B.对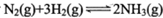 ,恒温恒容时充入N2,正反应速率增大,逆反应速率减小
,恒温恒容时充入N2,正反应速率增大,逆反应速率减小
C.已知25℃时Ksp(AgCl)=1.8×10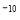 ,则在0.1 mo1
,则在0.1 mo1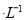 AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10
AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10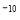 mo1
mo1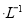 。
。
D.在酸碱中和滴定时,装标准液的滴定管未用标准液润洗直接装入标准液进行滴定,会引起测定结果浓度偏低
科目:高中化学 来源:2014-2015广东省佛山市高二下学期第一次月考理化学试卷(解析版) 题型:填空题
(10分)已知下列物质:①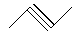 ,②
,②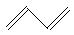 ,③
,③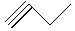 ,④
,④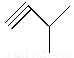 ,⑤
,⑤
请按要求填空:
(1)写出①④的名称________ 、________ ;
(2)写出②、⑤的分子式________ 、_______ _;
(3)互为同分异构体的是________ ;互为同系物的是_______
(4)写出③与等物质的量的Br2反应的化学方程式:____________________ _。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查一理综化学试卷(解析版) 题型:选择题
“蛟龙”号外壳用特殊的钛合金材料制成,它可以在深海中承受700个大气压的压力。已知金属钛的原子序数为22,化学性质与铝类似。下列说法正确的是
A.钛属于主族元素
B.钛合金强度很大
C.蒸干TiCl4溶液可得无水钛盐
D.在空气中将金属钛、铝混合后熔化可制得合金
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省资阳市高三第三次模拟考试理综化学试卷(解析版) 题型:选择题
下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1某二元弱酸的酸式盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
B.某酸式盐NaHY的水溶液显碱性,该酸式盐溶液中离子浓度关系为:c(Na+)>c(HY-)>c (OH-)>c(H+)
C.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
D.25 ℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:实验题
(16分)(1)下图所示都是实验室中制取气体的装置,其中能实现随开随用,随关随停的是____________,其中仪器B的名称是____________。
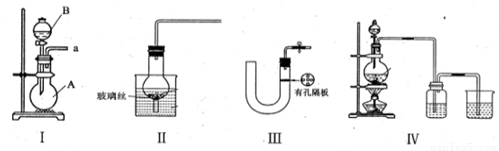
(2)请简述检验装置III的气密性的方法_________________________________.
(3)实验室利用铜和浓硫酸制取SO2,可选择上述气体发生装置的_________来实现。请写出其反应的化学方程式___________________________.
(4)若要用浓硫酸(质量分数为98%,密度为1.84g/mL)配制1 mol/L的稀硫酸500mL,则需要量取浓硫酸的体积为__________mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、_________。
(5)①若在100 ml 18 mol/L浓硫酸中加入过最铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是__________________。
A.40.32 L B.30.24 L C.20.16 L D.13.44 L
②若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,写出反应的离子方程_ 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
某溶液中除H+、OH-外,还含有大量的Mg2+、Fe3+、Cl-,且这三种离子的物质的量浓度之比为1: 1: 6.下列有关该溶液的判断正确的是
A.向该溶液中加入KI溶液后,原有的五种离子物质的量不变
B.向该溶液中摘加稀NaOH溶液,立即出现白色沉淀
C.向该溶液中加入过量铁粉,只发生置换反应
D.若溶液中c(Cl-)=0.6mol/L,则该溶液的pH为1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省渭南市高三教学质量检测(一模)化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
B.司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金
C.聚酯纤维、碳纤维、光导纤维都属于有机高分子材料
D.工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省六校高三第二次联考理综化学试卷(解析版) 题型:实验题
[化学——选修2化学与技术](15分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:

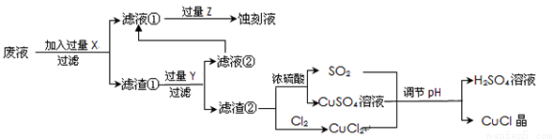
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是_____,现代氯碱工业的装置名称是_____________________。
(2)写出生产过程中X__________Y__________(填化学式)。
(3)写出产生CuCl的化学方程式________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_______________;生产过程中调节溶液的pH不能过大的原因是_____________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是______。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_______。
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ =Fe3+ + Ce3+ 如此再重复二次测得:
1 | 2 | 3 | |
空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为_________(平行实验结果相差不能超过0.3%)
查看答案和解析>>
科目:高中化学 来源:2014-2015上海市奉贤区高三第二学期调研测试化学试卷(解析版) 题型:选择题
某固体混合物的成分是Cu2(OH)2CO3、Na2S2O3、Ca(HCO3)2中的某两种。取75.6g该混合物,加足量稀盐酸完全反应,溶液中的阴离子只有Cl—、OH—。将生成的气体通入足量澄清石灰水中,得到63.0g沉淀。则该混合物的两种成分的物质的量之比可能为
A.65:51 B. 39:7 C.21:65 D.17:13
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com